题目内容
向硫酸氢钠溶液中滴加氢氧化钡溶液,溶液的pH与生成的沉淀关系如图所示,正确的是( )
A、 |
B、 |
C、 |
D、 |
考点:离子方程式的有关计算
专题:图示题
分析:硫酸氢钠溶液显酸性,在硫酸氢钠溶液中滴加氢氧化钡使溶液刚好呈中性NaHSO4和Ba(OH)2物质的量之比按照2:1反应,溶液呈中性,反应的离子方程式为:2H++SO42-+Ba2++2OH-=BaSO4↓+2H2O;随着反应的进行,会发生:SO42-+Ba2+=BaSO4↓沉淀继续增加至硫酸根沉淀完全.
解答:
解:硫酸氢钠溶液显酸性,在硫酸氢钠溶液中滴加氢氧化钡使溶液刚好呈中性NaHSO4和Ba(OH)2物质的量之比按照2:1反应,溶液呈中性,pH=7,
反应的离子方程式为:2H++SO42-+Ba2++2OH-=BaSO4↓+2H2O,沉淀了一半硫酸根离子;随着反应的进行,pH增加,会发生:SO42-+Ba2+=BaSO4↓沉淀继续增加至硫酸根沉淀完全,只有A图象符合,故选A.
反应的离子方程式为:2H++SO42-+Ba2++2OH-=BaSO4↓+2H2O,沉淀了一半硫酸根离子;随着反应的进行,pH增加,会发生:SO42-+Ba2+=BaSO4↓沉淀继续增加至硫酸根沉淀完全,只有A图象符合,故选A.
点评:本题考查了离子方程式的计算,根据二者反应原理分析沉淀和PH的变化是解题的关键.

练习册系列答案
 品学双优卷系列答案
品学双优卷系列答案 小学期末冲刺100分系列答案
小学期末冲刺100分系列答案 期末复习检测系列答案
期末复习检测系列答案 超能学典单元期中期末专题冲刺100分系列答案
超能学典单元期中期末专题冲刺100分系列答案
相关题目
跟50mL 1mol/L HCl溶液中H+离子的物质的量浓度相同的溶液是( )
| A、50 mL 1 mol/L醋酸溶液 |
| B、100 mL 0.5 mol/L硫酸溶液 |
| C、100 mL 0.25 mol/L硫酸溶液 |
| D、200 mL 1 mol/L硝酸溶液 |
下列说法不正确的是( )
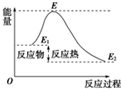

| A、反应物分子(或离子)间的每次碰撞是反应的先决条件 |
| B、反应物的分子的每次碰撞都能发生化学反应 |
| C、活化分子具有比普通分子更高的能量,催化剂能够减低活化能的数值 |
| D、活化能是活化分子的平均能量与所有分子平均能量之差,如图所示正反应的活化能为E-E1 |
下列叙述正确的是(NA为阿伏伽德罗常数)( )
| A、标况下,22.4L苯的分子数为NA |
| B、10.0mL 18mol/L的浓硫酸中氢离子数为0.36NA |
| C、6.4gS6与S8的混合物中所含S原子数一定为0.2NA |
| D、标准状况下,22.4L氯气与足量氢氧化钠溶液反应转移的电子数为2NA |
对于反应mA+nB═pC,下列说法正确的是( )
| A、某温度时,化学反应速率无论用A、B、C何种物质表示,其数值是相同的 |
| B、其他条件不变,增大压强,反应速率加快 |
| C、若增加或减小B的物质的量,则反应速率一定会发生明显的变化 |
| D、其他条件不变,升高温度,反应速率加快 |
下列说法正确的是(NA为阿伏加德罗常数)( )
| A、标准状况下,1L苯完全燃烧所生成的气态产物的分子数为6/22.4NA |
| B、1 mol甲基(-CH3)所含的电子总数为9NA |
| C、1 mol聚乙烯含有的原子数目为6NA |
| D、12 g金刚石中含有C-C键的个数为NA |

 合成氨工业对国民经济和社会发展具有重要的意义.一定温度下,在2L的密闭容器中加入一定量的N2和H2,发生合成氨反应,其中n(NH3)和n(H2)随时间变化的关系如图所示.
合成氨工业对国民经济和社会发展具有重要的意义.一定温度下,在2L的密闭容器中加入一定量的N2和H2,发生合成氨反应,其中n(NH3)和n(H2)随时间变化的关系如图所示.