题目内容
下列叙述正确的是(NA为阿伏伽德罗常数)( )
| A、标况下,22.4L苯的分子数为NA |
| B、10.0mL 18mol/L的浓硫酸中氢离子数为0.36NA |
| C、6.4gS6与S8的混合物中所含S原子数一定为0.2NA |
| D、标准状况下,22.4L氯气与足量氢氧化钠溶液反应转移的电子数为2NA |
考点:阿伏加德罗常数
专题:阿伏加德罗常数和阿伏加德罗定律
分析:A.标准状况下,苯的状态不是气体,不能使用标况下的气体摩尔体积计算苯的物质的量;
B.硫酸为共价化合物,浓硫酸中只有部分硫酸电离出氢离子;
C.6.4gS6与S8的混合物中含有6.4gS原子,含有0.2mol硫原子;
D.氯气与氢氧化钠溶液的反应中,氯气既是氧化剂也是还原剂,1mol氯气完全反应转移了1mol电子.
B.硫酸为共价化合物,浓硫酸中只有部分硫酸电离出氢离子;
C.6.4gS6与S8的混合物中含有6.4gS原子,含有0.2mol硫原子;
D.氯气与氢氧化钠溶液的反应中,氯气既是氧化剂也是还原剂,1mol氯气完全反应转移了1mol电子.
解答:
解:A.标况下苯不是气体,不能使用标况下的气体摩尔体积计算22.4L苯的物质的量,故A错误;
B.10.0mL 18mol/L的浓硫酸中含有0.18mol硫酸,由于浓硫酸中硫酸主要以分子形式存在,则溶液中含有的氢离子小于0.36mol,含有氢离子数小于0.36NA,故B错误;
C.6.4gS6与S8的混合物中含有6.4gS原子,6.4g硫的物质的量为0.2mol,所含S原子数一定为0.2NA,故C正确;
D.标况下22.4L氯气的物质的量为1mol,1mol氯气与氢氧化钠溶液反应转移了1mol电子,反应转移的电子数为NA,故D错误;
故选C.
B.10.0mL 18mol/L的浓硫酸中含有0.18mol硫酸,由于浓硫酸中硫酸主要以分子形式存在,则溶液中含有的氢离子小于0.36mol,含有氢离子数小于0.36NA,故B错误;
C.6.4gS6与S8的混合物中含有6.4gS原子,6.4g硫的物质的量为0.2mol,所含S原子数一定为0.2NA,故C正确;
D.标况下22.4L氯气的物质的量为1mol,1mol氯气与氢氧化钠溶液反应转移了1mol电子,反应转移的电子数为NA,故D错误;
故选C.
点评:本题考查阿伏加德罗常数的综合应用,题目难度中等,注意明确标况下气体摩尔体积的使用条件,掌握好以物质的量为中心的各化学量与阿伏加德罗常数的关系,选项B为易错点,注意浓硫酸中硫酸的电离情况.

练习册系列答案
 名师指导期末冲刺卷系列答案
名师指导期末冲刺卷系列答案 开心蛙口算题卡系列答案
开心蛙口算题卡系列答案
相关题目
下列离子方程式中正确的是( )
| A、稀硝酸和过量的铁屑反应:3Fe+8H++2NO3-=3Fe3++2NO↑+4H2O | ||||
B、NH4HCO3溶液与过量KOH浓溶液共热:NH4++OH-
| ||||
| C、向Ba(OH)2溶液中滴加NaHSO4溶液至恰好为中性:Ba2++OH-+H++SO42-=BaSO4↓+H2O | ||||
| D、KI溶液与H2SO4酸化的H2O2溶液混合:2I-+H2O2+2H+=2H2O+I2 |
有4种燃料电池下面是工作原理示意图,其中正极反应的产物为水的是( )
A、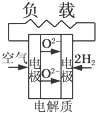 固体氧化物燃料电池 |
B、 碱性氢氧燃料电池 |
C、 质子交换膜燃料电池 |
D、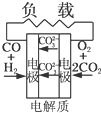 熔融盐燃料电池 |
对处于化学平衡的体系,由化学平衡与化学反应速率的关系可知( )
| A、化学反应速率变化时,化学平衡一定发生移动 |
| B、化学平衡发生移动时,化学反应速率一定变化 |
| C、正反应进行的程度大,正反应速率一定大 |
| D、改变压强,化学反应速率一定改变,平衡一定移动 |
在一定条件下,CO和CH4的燃烧热分别为△H=-283kJ?mol-1和△H=-890kJ?mol-1又知由H2与O2反应生成1mol液态H2O比生成1mol气态H2O 多放出44kJ/mol的热量.则CH4气在空气中不完全燃烧的热化学方程式正确的是( )
A、2CH4(g)+
| ||
B、2CH4(g)+
| ||
| C、3CH4(g)+5O2(g)=CO2(g)+2CO(g)+6H2O(g);△H=-1840kJ?mol-1 | ||
| D、3CH4(g)+5O2(g)=CO2(g)+2CO(g)+6H2O(1);△H=-1538kJ?mol-1 |
除去下列物质中少量杂质的方法正确的是( )
| A、除去Fe2(SO4)3溶液中混有的Fe SO4:加入足量新制氯水 |
| B、除去FeCl2溶液中混有的FeCl3:加入足量铁粉,过滤 |
| C、铝粉中的镁粉,加入足量氢氧化钠溶液,过滤 |
| D、除去Cu粉中混有的CuO:加适量稀硝酸后,过滤、洗涤 |




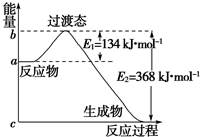 参考下列图表和有关要求回答问题:
参考下列图表和有关要求回答问题: