题目内容
5.某反应的反应热△H=+100kJ/mol.下列有关该反应的叙述正确的是( )| A. | 正反应的活化能小于100kJ/mol | |
| B. | 逆反应活化能一定小于100kJ/mol | |
| C. | 正反应活化能小于100kJ/mol | |
| D. | 正反应活化能比逆反应活化能大100kJ/mol |
分析 在可逆反应过程中活化能有正反应和逆反应两种,焓变与活化能的关系是△H=正反应的活化能-逆反应的活化能;该反应的焓变△H>0,则反应物的总能量小于生成物的总能量,据此进行解答.
解答 解:A.某反应的△H=+100kJ•mol-1,则正反应的活化能-逆反应的活化能=100kJ•mol-1,无法确定正反应活化能的大小,故A错误;
B.某反应的△H=+100kJ•mol-1,则正反应的活化能-逆反应的活化能=+100kJ•mol-1,无法确定逆反应活化能的大小,故B错误;
C.某反应的△H=+100kJ•mol-1,则正反应的活化能-逆反应的活化能=+100kJ•mol-1,正反应活化能大于100kJ•mol-1,故C错误;
D.某反应的△H=+100kJ•mol-1,则正反应的活化能-逆反应的活化能=+100kJ•mol-1,即正反应活化能比逆反应活化能大100 kJ•mol-1,故D正确;
故选D.
点评 本题主要考查反应热与焓变的应用,题目难度不大,明确反应热与活化能之间的关系为解答关键,注意掌握化学反应与能量变化的关系,试题培养了学生的灵活应用能力.

练习册系列答案
相关题目
10.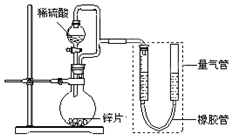 某同学设计了如图所示装置(部分夹持装置已略去),该装置可以用来进行多项实验研究.
某同学设计了如图所示装置(部分夹持装置已略去),该装置可以用来进行多项实验研究.
请回答:
(1)用上述装置探究影响化学反应速率的因素.
①圆底烧瓶中发生反应的离子方程式是Zn+2H+=Zn2++H2↑.
②用上述装置进行实验,以生成9.0mL气体为计时终点,结果为t1>t2
比较实验Ⅰ和Ⅱ可以得出的实验结论是在其它条件一定时,化学反应速率随反应物浓度的增大而增大.
③若将锌片换成含杂质的粗锌片,且控制其他条件使其与上述实验完全一致,所测得的反应速率均大于上述实验对应的数据.粗锌片中所含杂质可能是abc(填序号).
a.石墨 b.银 c.铜 d.沙粒(二氧化硅)
(2)用上述装置测定粗锌片的纯度.
①连接好装置,检查装置气密性,称量粗锌片mg置于圆底烧瓶中,滴加足量稀硫酸,充分反应直至不再产生气体为止,测得气体体积为VL,则粗锌片的纯度为$\frac{65V}{22.4m}$×100%.
②本实验在读数前对量气管的操作是调整左右两管的液面高度相平,且视线与液面相平.
③本套装置中若考虑滴入的稀硫酸的体积(假设其它操作都正确),则测得的气体的体积将.无影响(填“偏大”、“偏小”或“无影响”,)
(3)用上述装置验证生铁在潮湿空气中会发生吸氧腐蚀.
①圆底烧瓶中的试剂可选用c(填序号).
NH4Cl溶液 b.C2H5OH c.Na2CO3溶液 d.稀硫酸
②能证明生铁在潮湿空气中会发生吸氧腐蚀的现象是量气管右端液面下降,左端液面上升.
 某同学设计了如图所示装置(部分夹持装置已略去),该装置可以用来进行多项实验研究.
某同学设计了如图所示装置(部分夹持装置已略去),该装置可以用来进行多项实验研究.请回答:
(1)用上述装置探究影响化学反应速率的因素.
①圆底烧瓶中发生反应的离子方程式是Zn+2H+=Zn2++H2↑.
②用上述装置进行实验,以生成9.0mL气体为计时终点,结果为t1>t2
| 序号 | V(H2SO4)/mL | c(H2SO4)/mol•L-1 | t/s |
| Ⅰ | 40 | 1 | t1 |
| Ⅱ | 40 | 4 | t2 |
③若将锌片换成含杂质的粗锌片,且控制其他条件使其与上述实验完全一致,所测得的反应速率均大于上述实验对应的数据.粗锌片中所含杂质可能是abc(填序号).
a.石墨 b.银 c.铜 d.沙粒(二氧化硅)
(2)用上述装置测定粗锌片的纯度.
①连接好装置,检查装置气密性,称量粗锌片mg置于圆底烧瓶中,滴加足量稀硫酸,充分反应直至不再产生气体为止,测得气体体积为VL,则粗锌片的纯度为$\frac{65V}{22.4m}$×100%.
②本实验在读数前对量气管的操作是调整左右两管的液面高度相平,且视线与液面相平.
③本套装置中若考虑滴入的稀硫酸的体积(假设其它操作都正确),则测得的气体的体积将.无影响(填“偏大”、“偏小”或“无影响”,)
(3)用上述装置验证生铁在潮湿空气中会发生吸氧腐蚀.
①圆底烧瓶中的试剂可选用c(填序号).
NH4Cl溶液 b.C2H5OH c.Na2CO3溶液 d.稀硫酸
②能证明生铁在潮湿空气中会发生吸氧腐蚀的现象是量气管右端液面下降,左端液面上升.
17.能表示阿伏加德罗常数的数值是( )
| A. | 1mol金属钠含有的电子数 | |
| B. | 标准状况下,22.4L酒精所含的分子数 | |
| C. | 12g12C所含的原子数 | |
| D. | 1L 1mol/L的硫酸溶液中所含的H+ |
14.NA表示阿伏加德罗常数,下列说法正确的是( )
| A. | 18g2H2O中含有的电子数目为NA | |
| B. | 0.1L0.5mol/LCH3COOH溶液中含有的氢离+数为0.05NA | |
| C. | 常温常压,22.4LC12中含有的分子数为6.02×1023个 | |
| D. | 常温常压下,足量的金属Al与lmolCl2共热,转移电子数为2NA |
15.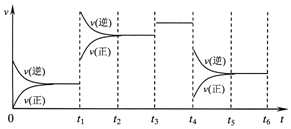 某密闭容器中发生如下反应:X(g)+3Y(g)?2Z(g);△H<0,如图表示该反应的速率(v)随时间(t)变化的关系,t1、t3、t4时刻外界条件有所改变,但都没有改变各物质的初始加入量.下列说法中不正确的是( )
某密闭容器中发生如下反应:X(g)+3Y(g)?2Z(g);△H<0,如图表示该反应的速率(v)随时间(t)变化的关系,t1、t3、t4时刻外界条件有所改变,但都没有改变各物质的初始加入量.下列说法中不正确的是( )
 某密闭容器中发生如下反应:X(g)+3Y(g)?2Z(g);△H<0,如图表示该反应的速率(v)随时间(t)变化的关系,t1、t3、t4时刻外界条件有所改变,但都没有改变各物质的初始加入量.下列说法中不正确的是( )
某密闭容器中发生如下反应:X(g)+3Y(g)?2Z(g);△H<0,如图表示该反应的速率(v)随时间(t)变化的关系,t1、t3、t4时刻外界条件有所改变,但都没有改变各物质的初始加入量.下列说法中不正确的是( )| A. | t1时升高了温度 | B. | t3时加入了催化剂 | ||
| C. | t5~t6时刻,Y转化率最小 | D. | 在t3~t4时间内,X的体积分数最大 |
 H++ OH- ΔH > 0,下列叙述正确的是
H++ OH- ΔH > 0,下列叙述正确的是