题目内容
2.实验室合成乙酸乙酯的步骤如下:在圆底烧瓶内加入乙醇、浓硫酸和乙酸,瓶口竖直安装通有冷却水的冷凝管(使反应混合物的蒸气冷凝为液体流回烧瓶内),加热回流一段时间后换成蒸馏装置进行蒸馏,得到含有乙醇、乙酸和水的乙酸乙酯粗产品.请回答下列问题:(1)在烧瓶中除了加入乙醇、浓硫酸和乙酸外,还应放入碎瓷片,目的是防止暴沸.
(2)浓硫酸的作用是催化剂、吸水剂.
(3)生成乙酸乙酯的反应方程式为CH3CH2OH+CH3COOH$→_{△}^{浓硫酸}$CH3CH2OOCCH3+H2O.
(4)现拟分离含乙酸、乙醇和水的乙酸乙酯粗产品,如图是分离操作步骤流程图.请在图中小括号内填入适当的试剂,在中括号内填入适当的分离方法.
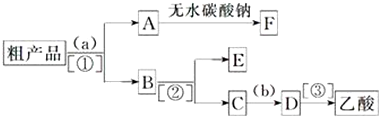
试剂a是饱和碳酸钠溶液,试剂b是稀硫酸;分离方法①是萃取分液,分离方法②是蒸馏,分离方法③是蒸馏.F是乙酸乙酯、E是乙醇.
(5)在得到的A中加入无水碳酸钠粉末,振荡,目的是除去乙酸乙酯中的水.
分析 (1)对于液体加热蒸馏,应加入碎瓷片,防止暴沸;
(2)实验室合成乙酸乙酯的实验中浓硫酸作催化剂和吸水剂;
(3)乙酸、乙醇发生酯化反应生成乙酸乙酯;
(4)粗产品乙酸乙酯中含有乙酸与乙醇,用饱和的碳酸钠溶液反应掉乙酸,溶解乙醇,同时降低乙酸乙酯的溶解度,便于溶液分层,乙酸乙酯密度比水小,乙酸乙酯在上层,然后利用分液,乙酸乙酯加入无水碳酸钠吸收其中的水,可得乙酸乙酯;溶液中含有乙醇、碳酸钠、乙酸钠,进行蒸馏可以收集乙醇,向蒸出乙醇的溶液中加入硫酸,可以得到乙酸,再进行蒸馏可以收集乙酸;
(5)得到的乙酸乙酯中加入无水碳酸钠粉末,振荡,除去乙酸乙酯的水份.
解答 解:(1)对于液体加热蒸馏,应加入碎瓷片,防止暴沸;
故答案为:碎瓷片;防止暴沸;
(2)反应为可逆反应,加入浓硫酸,可起到催化剂的作用,且浓硫酸具有吸水性,有利于反应正向移动,故答案为:催化剂、吸水剂;
(3)乙酸、乙醇发生酯化反应生成乙酸乙酯,反应的化学方程式为CH3CH2OH+CH3COOH$→_{△}^{浓硫酸}$CH3CH2OOCCH3+H2O,
故答案为:CH3CH2OH+CH3COOH$→_{△}^{浓硫酸}$CH3CH2OOCCH3+H2O;
(4)粗产品乙酸乙酯中含有乙酸与乙醇,用饱和的碳酸钠溶液反应掉乙酸,溶解乙醇,同时降低乙酸乙酯的溶解度,便于溶液分层,乙酸乙酯密度比水小,乙酸乙酯在上层,然后利用分液,乙酸乙酯加入无水碳酸钠吸收其中的水,可得乙酸乙酯;溶液中含有乙醇、碳酸钠、乙酸钠,进行蒸馏可以收集乙醇,向蒸出乙醇的溶液中加入硫酸,可以得到乙酸,再进行蒸馏可以收集乙酸;
故答案为:饱和碳酸钠溶液;稀硫酸;萃取分液;蒸馏;蒸馏;乙酸乙酯; 乙醇;
(5)分液得到的乙酸乙酯中含有水分,加入无水碳酸钠粉末,振荡,除去乙酸乙酯的水份.
故答案为:除去乙酸乙酯中的水.
点评 本题考查乙酸乙酯的制备,为高频考点,侧重于学生的分析能力和实验能力的考查,难度不大,注意实验混合液的配制、饱和碳酸钠溶液的作用以及酯化反应的机理,(4)中试剂b选择,由于盐酸易挥发,不能使用盐酸.

 一诺书业暑假作业快乐假期云南美术出版社系列答案
一诺书业暑假作业快乐假期云南美术出版社系列答案| A. | 少量的CO2通入NaClO溶液中发生反应:NaClO+CO2+H2O=NaHCO3+HClO,说明酸性强弱的顺序为H2CO3>HClO>HCO3- | |
| B. | 金刚石是自然界中硬度最大的物质,不可能与氧气发生反应 | |
| C. | 浓H2SO4具有强氧化性,常温下就能与金属Cu发生剧烈反应 | |
| D. | NO2与H2O 反应的过程中,被氧化的氮原子与被还原的氮原子的个数比为1:2 |
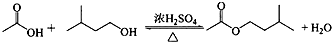
| 相对分子质量 | 密度/(g•cm-3) | 沸点/℃ | 水中溶解性 | |
| 异戊醇 | 88 | 0.8123 | 131 | 微溶 |
| 乙酸 | 60 | 1.0492 | 118 | 溶 |
| 乙酸异戊酯 | 130 | 0.8670 | 142 | 难溶 |
在A中加入4.4g的异戊醇、6.0g的乙酸、数滴浓硫酸和2~3片碎瓷片.开始缓慢加热A,回流50min.反应液冷至室温后倒入分液漏斗中,分别用少量水、饱和碳酸氢钠溶液和水洗涤;分出的产物加入少量无水MgSO4固体,静置片刻,过滤除去MgSO4固体,进行蒸馏纯化,收集140~143℃馏分,得乙酸异戊酯3.9g.
回答下列问题:
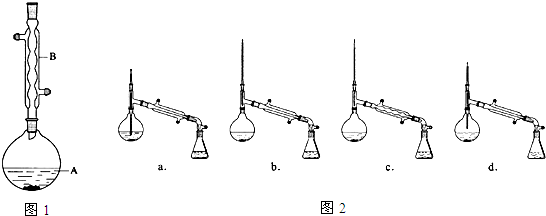
(1)仪器B的名称是球形冷凝管.
(2)在洗涤操作中,第一次水洗的主要目的是洗掉大部分硫酸和醋酸,第二次水洗的主要目的是洗掉碳酸氢钠.
(3)在洗涤、分液操作中,应充分振荡,然后静置,待分层后d(填标号).
a.直接将乙酸异戊酯从分液漏斗的上口倒出
b.直接将乙酸异戊酯从分液漏斗的下口放出
c.先将水层从分液漏斗的下口放出,再将乙酸异戊酯从下口放出
d.先将水层从分液漏斗的下口放出,再将乙酸异戊酯从上口倒出
(4)本实验中加入过量乙酸的目的是提高醇的转化率.
(5)实验中加入少量无水MgSO4的目的是干燥乙酸异戊酯.
(6)在蒸馏操作中,仪器选择及安装都正确的是图2中的b(填标号).
(7)本实验的产率是c(填标号).
a.30% b.40% c.60% d.90%
(8)在进行蒸馏操作时,若从130℃便开始收集馏分,会使实验的产率偏高(填“高”或“低”) 原因是会收集少量未反应的异戊醇.
【提出猜想】
Ⅰ.所得溶液中的金属离子可能含有Fe2+和Fe3+中的一种或两种;
Ⅱ.所得气体中可能含有SO2、H2中的一种或两种.
【实验探究】
| , | 实验操作 | 预期现象 | 结 论 |
| 验证猜想I] | 步骤①:取少量0.01mol/L 酸性KMnO4溶液,滴入所得溶液中 | 溶液紫红色褪去 | 含有Fe2+ |
| 步骤②:另取少量所得溶液,滴加KI溶液和淀粉溶液 | 溶液不变为蓝色 | 不含Fe3+ | |
| 验证猜想Ⅱ | 将所得气体通入如下装置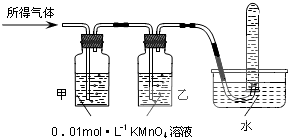 | 甲中KMnO4溶液褪色,乙中KMnO4溶液颜色不变,试管中收集到气体 | 含有两种气体 |
回答下列问题:
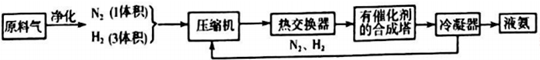
(1)合成氨所需的氮气来源于空气;合成氨所需的原料气氢气可由天然气制备,其主要反应为CH4(g)+H2O(g)=CO(g)+3H2(g);CH4和O2的反应:2CH4(g)+O2(g)=2CO(g)+4H2(g).CH4和H2O(g)及富氧空气(O2含量较高,不同富氧空气中氧气含量不同)混合反应,产物气体组成如表:
| 气体 | CO | H2 | N2 | O2 |
| 体积(L) | 25 | 60 | 15 | 2.5 |
(2)在合成氨的原科气中混有的杂质必须除去的原因是防止催化剂中毒;
上述流程中热交换器的作用是热交换器是利用合成氨和氨冷凝放出的热量来加热原料气体或预热反应混合气.从合成塔出来的混合气体,通常仅含有15%(体积分数)的氨.为提高原料的利用率,通常采取的措施是将N2,H2循环利用.
(3)合成氮为放热反应,但工业上采用400℃-500℃的温度,主要原因是:
①该温度范围内反应速率较快.②该温度下催化剂的活性较大.
(4)氨可与CO2反应制备尿素(CO(NH2)2],反应过程分为两步,试写出有关的化学方程式:
①氮气与二氧化碳在加热加压条件下化合生成氨基甲酸铵(H2NCOONH4):2NH3+CO2$\stackrel{加热加压}{→}$H2NCOONH4.
②氨基甲酸铵受热分解为尿素与水:H2NCOONH4$\stackrel{△}{→}$CO(NH2)2+H2O.
(5)新法合成氨常采用电解法合成.即常压下将氢气和用氢气稀释的氮气分别通入一个加热到570℃的电解池中,氢气和氮气在电极上合成了氨,大大提高了氨的产率.新法合成氨所用的电解质能传导H+,则阴极的电极反应式为N2+6H++6e-═2NH3.
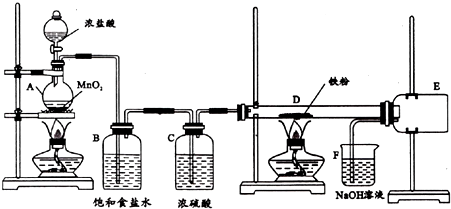
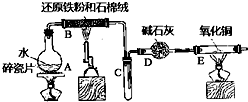 某实验小组利用下图所列装置进行“铁与水蒸气反应”的实验,并利用产物进一步制取FeCl3•6H2O晶体.(图中夹持及尾气处理装置均已略去)请回答下列问题:
某实验小组利用下图所列装置进行“铁与水蒸气反应”的实验,并利用产物进一步制取FeCl3•6H2O晶体.(图中夹持及尾气处理装置均已略去)请回答下列问题: