题目内容
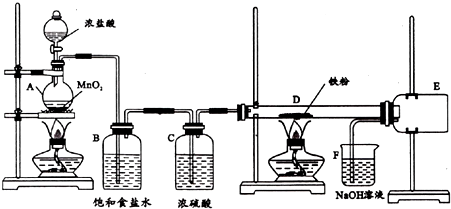
19. 二氧化氯是一种高效消毒剂,在60℃时用氯酸钾与草酸反应可生成二氧化氯,实验装置如图所示:
二氧化氯是一种高效消毒剂,在60℃时用氯酸钾与草酸反应可生成二氧化氯,实验装置如图所示:已知:通常状况下二氧化氯沸点为11.0℃,极易爆炸,制取和使用二氧化氯时要用性质稳定的气体稀释,以防爆炸.回答下列问题:
(1)装置A中产物有K2CO3、ClO2和CO2等,写出该反应的化学方程式:2ClO3-+H2C2O4$\frac{\underline{\;60℃\;}}{\;}$CO32-+CO2↑+2ClO2↑+H2O;装置A中还应安装的玻璃仪器是温度计,其作用是控制水浴加热温度为60℃.
(2)装置B用冰水浴的原因是常温下二氧化氯为气态,用冰水将其冷凝为液态,以防爆炸;
(3)实验过程中,装置C的溶液中除了会产生少量Na2CO3外还会生成等物质的量的另外两种钠盐,其中一种为为NaClO2,则另一种钠盐的化学式为NaClO3.
(4)已知NaClO2饱和溶液在温度低于38℃时析出晶体NaClO2.3H2O,在温度高于38℃时析出晶体NaClO2.请补充从NaClO2溶液中制得NaClO2晶体的操作步骤:a.(减压)蒸发浓缩;b低于38℃时冷却结晶;c.过滤、洗涤;d.干燥.
(5)工业上常用盐酸或双氧水还原氯酸钠制备ClO2,用H2O2制备的ClO2比用盐酸制备的ClO2更适合用于饮用水的消毒,其主要原因是H2O2作还原剂时氧化产物为O2,而盐酸作还原剂时产生大量Cl2.
分析 在60℃时利用氯酸钾与草酸(中强酸)反应制备二氧化氯,并同时生成K2CO3和CO2等,为有效控制温度可使用水浴加热的方式,根据二氧化氯的沸点为11.0℃,易液化,可选择B装置冷却降温收集ClO2,考虑到ClO2极易爆炸,制取和使用二氧化氯时要用性质确定的气体如氮气稀释,以防爆炸,并利用NaOH吸收含ClO2的尾气,防止环境污染,
(1)装置A中氯酸钾与草酸(中强酸)反应得到二氧化氯,并同时生成K2CO3和CO2等,可根据质量守恒和原子守恒书写方程式;反应需要控制温度为60℃,测定仪器为温度计;
(2)装置B用冰水浴的目的是降温,使ClO2液化,防止气态ClO2爆炸;
(3)用NaOH吸收含有ClO2的尾气,产生之一为NaClO2,可见发生了氧化还原反应,可结合电子守恒和原子守恒判断产物;
(4)根据NaClO2饱和溶液在温度低于38℃时析出的晶体是NaClO2•3H2O,在温度高于38℃时析出的晶体是NaClO2,故从NaClO2溶液中制得NaClO2•3H2O需要在低温下进行,可选择减压蒸发并低温冷却结晶,最后过滤、洗涤、干燥得到NaClO2•3H2O;
(5)盐酸或双氧水均能还原氯酸钠制备ClO2,但H2O2的氧化产物为O2,而盐酸的氧化产物为氯气,对环境有污染.
解答 解:(1)装置A中氯酸钾与草酸(中强酸)反应制备二氧化氯,发生反应的化学方程式为2ClO3-+H2C2O4$\frac{\underline{\;60℃\;}}{\;}$CO32-+CO2↑+2ClO2↑+H2O;可利用温度计测定水浴温度,达到控制温度为60℃的目的,
故答案为:2ClO3-+H2C2O4$\frac{\underline{\;60℃\;}}{\;}$CO32-+CO2↑+2ClO2↑+H2O;温度计;控制水浴加热温度为60℃;
(2)保用装置B的目的是为防止气态ClO2爆炸,利用冰水浴降温,使ClO2液化,
故答案为:常温下二氧化氯为气态,用冰水将其冷凝为液态,以防爆炸;
(3)用NaOH吸收ClO2,产物NaClO2为还原产物,根据氧化还原反应的本质,另一产物为氧化产物,NaClO2中氯为+3,从+4到+3降1价,则氧化产物从+4升高一价为+5价,此时得到的二种产物才等物质的量,也满足电子守恒,即所得产物为NaClO3,
故答案为:NaClO3;
(4)防止析出的晶体是NaClO2,采用减压蒸发并低温冷却结晶,最后过滤、洗涤、干燥得到NaClO2•3H2O,
故答案为:(减压)蒸发浓缩;低于38℃时冷却结晶;
(5)H2O2的氧化产物为O2,盐酸的氧化产物为氯气,对环境有污染,则选择用H2O2制备的ClO2比用盐酸制备的ClO2更适合用于饮用水的消毒,
故答案为:H2O2作还原剂时氧化产物为O2,而盐酸作还原剂时产生大量Cl2.
点评 本题是物质制备实验探究分析,为高考常见题型和高频考点,题目考查制备原理分析、混合物的分离提纯、实验条件选择等,属基础考查,对提高学生分析问题解决问题的能力有促进作用,难度适中.

 全优点练单元计划系列答案
全优点练单元计划系列答案| A. | Cu+2HCl═CuCl2+H2↑ | B. | Al2O3+3H2O═2Al(OH)3 | ||
| C. | Mg(OH)2 $\frac{\underline{\;\;△\;\;}}{\;}$ MgO+H2O | D. | Ba(OH)2+SO2═BaSO4↓+H2O |
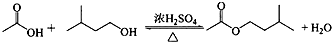
| 相对分子质量 | 密度/(g•cm-3) | 沸点/℃ | 水中溶解性 | |
| 异戊醇 | 88 | 0.8123 | 131 | 微溶 |
| 乙酸 | 60 | 1.0492 | 118 | 溶 |
| 乙酸异戊酯 | 130 | 0.8670 | 142 | 难溶 |
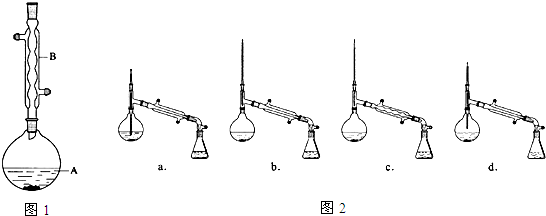
在A中加入4.4g的异戊醇、6.0g的乙酸、数滴浓硫酸和2~3片碎瓷片.开始缓慢加热A,回流50min.反应液冷至室温后倒入分液漏斗中,分别用少量水、饱和碳酸氢钠溶液和水洗涤;分出的产物加入少量无水MgSO4固体,静置片刻,过滤除去MgSO4固体,进行蒸馏纯化,收集140~143℃馏分,得乙酸异戊酯3.9g.
回答下列问题:
(1)仪器B的名称是球形冷凝管.
(2)在洗涤操作中,第一次水洗的主要目的是洗掉大部分硫酸和醋酸,第二次水洗的主要目的是洗掉碳酸氢钠.
(3)在洗涤、分液操作中,应充分振荡,然后静置,待分层后d(填标号).
a.直接将乙酸异戊酯从分液漏斗的上口倒出
b.直接将乙酸异戊酯从分液漏斗的下口放出
c.先将水层从分液漏斗的下口放出,再将乙酸异戊酯从下口放出
d.先将水层从分液漏斗的下口放出,再将乙酸异戊酯从上口倒出
(4)本实验中加入过量乙酸的目的是提高醇的转化率.
(5)实验中加入少量无水MgSO4的目的是干燥乙酸异戊酯.
(6)在蒸馏操作中,仪器选择及安装都正确的是图2中的b(填标号).
(7)本实验的产率是c(填标号).
a.30% b.40% c.60% d.90%
(8)在进行蒸馏操作时,若从130℃便开始收集馏分,会使实验的产率偏高(填“高”或“低”) 原因是会收集少量未反应的异戊醇.
| 乙醇 | 溴乙烷 | 正丁醇 | 1-溴丁烷 | |
| 密度/(g•cm-3) | 0.789 3 | 1.460 4 | 0.809 8 | 1.275 8 |
| 沸点/℃ | 78.5 | 38.4 | 117.2 | 101.6 |
(2)将1-溴丁烷粗产品置于分液漏斗中,加水振荡后静置,产物在下层(填“上层”“下层”或“不分层”).
(3)制备操作中,加入的浓硫酸必须进行稀释,其目的是ABC(填字母).
A.减少副产物烯和醚的生成 B.减少Br2的生成
C.减少HBr的挥发 D.水是反应的催化剂
(4)欲除去溴代烷中的少量杂质Br2,下列物质中最适合的是C(填字母).
A.NaI B.NaOH C.NaHSO3 D.KCl
(5)在制备溴乙烷时,采用边反应边蒸馏产物的方法,目的是:平衡向生成溴乙烷的方向移动(或反应②向右移动)
但在制备1-溴丁烷时却不能边反应边蒸馏,其原因:1-溴丁烷和正丁醇的沸点相差不大.
回答下列问题:
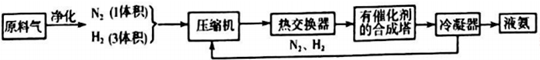
(1)合成氨所需的氮气来源于空气;合成氨所需的原料气氢气可由天然气制备,其主要反应为CH4(g)+H2O(g)=CO(g)+3H2(g);CH4和O2的反应:2CH4(g)+O2(g)=2CO(g)+4H2(g).CH4和H2O(g)及富氧空气(O2含量较高,不同富氧空气中氧气含量不同)混合反应,产物气体组成如表:
| 气体 | CO | H2 | N2 | O2 |
| 体积(L) | 25 | 60 | 15 | 2.5 |
(2)在合成氨的原科气中混有的杂质必须除去的原因是防止催化剂中毒;
上述流程中热交换器的作用是热交换器是利用合成氨和氨冷凝放出的热量来加热原料气体或预热反应混合气.从合成塔出来的混合气体,通常仅含有15%(体积分数)的氨.为提高原料的利用率,通常采取的措施是将N2,H2循环利用.
(3)合成氮为放热反应,但工业上采用400℃-500℃的温度,主要原因是:
①该温度范围内反应速率较快.②该温度下催化剂的活性较大.
(4)氨可与CO2反应制备尿素(CO(NH2)2],反应过程分为两步,试写出有关的化学方程式:
①氮气与二氧化碳在加热加压条件下化合生成氨基甲酸铵(H2NCOONH4):2NH3+CO2$\stackrel{加热加压}{→}$H2NCOONH4.
②氨基甲酸铵受热分解为尿素与水:H2NCOONH4$\stackrel{△}{→}$CO(NH2)2+H2O.
(5)新法合成氨常采用电解法合成.即常压下将氢气和用氢气稀释的氮气分别通入一个加热到570℃的电解池中,氢气和氮气在电极上合成了氨,大大提高了氨的产率.新法合成氨所用的电解质能传导H+,则阴极的电极反应式为N2+6H++6e-═2NH3.
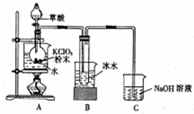
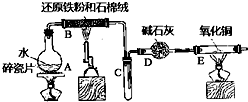 某实验小组利用下图所列装置进行“铁与水蒸气反应”的实验,并利用产物进一步制取FeCl3•6H2O晶体.(图中夹持及尾气处理装置均已略去)请回答下列问题:
某实验小组利用下图所列装置进行“铁与水蒸气反应”的实验,并利用产物进一步制取FeCl3•6H2O晶体.(图中夹持及尾气处理装置均已略去)请回答下列问题: