题目内容
18.某元素R在其氢氧化物和硝酸盐中的化合价均为+n,若上述两化合物的式量分别为M、N,则n为( )| A. | $\frac{(N-M)}{45}$ | B. | $\frac{(M-N)}{45}$ | C. | $\frac{(M-N)}{90}$ | D. | $\frac{(N-M)}{90}$ |
分析 根据相对分子的质量为组成分子的各原子的相对原子质量之和列方程来计算.
解答 解:该元素为R,化合价为+n价,设其相对原子质量为x,则氢氧化物的分子式为R(OH)n,硝酸盐的分子式为R(NO3)n,则
$\left\{\begin{array}{l}{17n+x=M}\\{62n+x=N}\end{array}\right.$解得:x=$\frac{(N-M)}{45}$,
故选:A.
点评 本题不仅考查了化学式的书写及意义,而且考查了相对分子质量的概念和常见元素的化合价及其应用等,综合性较强,解答本题时首先要理清解题思路,然后大胆地设未知量,列式求解即可,题目难度不大.

练习册系列答案
相关题目
9.甲醛(H2C=O)在Ni催化作用下加氢可得甲醇(CH3OH),以下说法中正确的是( )
| A. | 甲醇、甲醛分子间都可以形成氢键 | |
| B. | 甲醇分子内C原子C原子采取sp2杂化,O原子采取sp杂化 | |
| C. | 甲醛为极性分子,分子中两个C-H键夹角小于120° | |
| D. | 甲醇分子内的O-C-H键角大于甲醛分子内的O-C-H键角 |
6.下列关于原子结构、元素性质的说法正确的是( )
| A. | 只含非金属元素的化合物不能形成离子键 | |
| B. | 碱金属元素是同周期中金属性最强的元素 | |
| C. | 同种元素的原子均有相同的质子数和中子数 | |
| D. | 卤族元素的阴离子还原性越强,其最高价氧化物水化物的酸性越强 |
13.为了说明影响化学反应快慢的因素,甲、乙、丙、丁四位学生分别设计了如下A-D四个实验,你认为结论不正确的是( )
| A. | 将浓硝酸分别放在冷暗处和强光照射下,会发现强光照可以加快浓硝酸的分解 | |
| B. | 在相同条件下,等质量的大理石块和大理石粉与相同的盐酸反应,大理石粉反应快 | |
| C. | 将相同大小、形状的镁条和铝条与相同浓度的盐酸反应时,两者速率一样大 | |
| D. | 两支试管中分别加入相同质量的氯酸钾,其中一支试管中再加入少量二氧化锰,另一支试管不加;同时加热,产生氧气的快慢不同 |
3.科学家预言,298114F1将是最稳定的同位素,该同位素院子的中子数和质子数之差是( )
| A. | 70 | B. | 114 | C. | 184 | D. | 289 |
7.下列说法正确的是( )
| A. | 17g OH-中含有的电子数为10 NA | |
| B. | 标准状况下,将2.24L Cl2溶于水,可得到HClO分子的数目是0.1NA | |
| C. | NA个Fe(OH)3胶体粒子的质量为107g | |
| D. | 44克14C16O2含氧原子数为2NA |
8.下列有关说法正确的是( )
| A. | 在海轮外壳上镶入锌块,可减缓船体的腐蚀速率 | |
| B. | 铅蓄电池在放电时,两极质量均增加 | |
| C. | 钢铁在中性溶液中主要繁盛析氢腐蚀 | |
| D. | 在室温下能自发进行的反应,其△H一定小于0 |
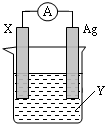 依据氧化还原反应:2Ag+(aq)+Zn(s)=Zn2+(aq)+2Ag(s) 设计的原电池如图所示.请回答下列问题:
依据氧化还原反应:2Ag+(aq)+Zn(s)=Zn2+(aq)+2Ag(s) 设计的原电池如图所示.请回答下列问题: .
.