题目内容
8.下列有关说法正确的是( )| A. | 在海轮外壳上镶入锌块,可减缓船体的腐蚀速率 | |
| B. | 铅蓄电池在放电时,两极质量均增加 | |
| C. | 钢铁在中性溶液中主要繁盛析氢腐蚀 | |
| D. | 在室温下能自发进行的反应,其△H一定小于0 |
分析 A、在原电池中正极被保护;
B、根据铅蓄电池中的电极反应分析;
C、钢铁在酸性条件下发生析氢腐蚀;
D、反应自发进行的判断依据是△H-T△S<0.
解答 解:A、在海轮的外壳上镶入锌块,会和铁形成原电池,锌做负极,海轮做正极,而在原电池中正极被保护,故可减缓船体的腐蚀,故A正确;
B、放电时,铅失电子发生氧化反应而作负极,电极反应式为Pb-2e-+SO42-=PbSO4,二氧化铅得电子作正极,电极反应式为PbO2+SO42-+2e-+4H+═PbSO4+2H2O,两极均生成难溶性的PbSO4,所以两极质量均增加,故B正确;
C、钢铁在酸性条件下发生析氢腐蚀,在中性或弱酸性条件下发生吸氧腐蚀,故C错误;
D、反应自发进行的判断依据是△H-T△S<0,在室温下能自发进行的反应,其△H不一定小于0,故D错误;
故选AB.
点评 本题考查了金属的电化学腐蚀及防护,难度不大,应注意的是在原电池中正极被保护,在电解池中阴极被保护.

练习册系列答案
相关题目
18.某元素R在其氢氧化物和硝酸盐中的化合价均为+n,若上述两化合物的式量分别为M、N,则n为( )
| A. | $\frac{(N-M)}{45}$ | B. | $\frac{(M-N)}{45}$ | C. | $\frac{(M-N)}{90}$ | D. | $\frac{(N-M)}{90}$ |
19.设NA为阿佛加德罗常数,下列说法错误的是( )
| A. | 在标准状况下,22.4L C5H10所含的碳原子数目为5NA | |
| B. | 常温常压下,7.8g过氧化钠含有的离子数为0.3NA | |
| C. | 18g水所含的电子数目为10NA | |
| D. | 3.2g O2、O3混合物中所含氧原子一定是0.2NA |
16.胡椒酚是植物挥发油中的一种成分.关于胡椒酚的下列说法正确的是( )
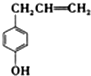

| A. | 该化合物属于芳香烃 | |
| B. | 1mol该化合物最多可与3molBr2发生反应 | |
| C. | 它的部分同分异构体能发生银镜反应 | |
| D. | 该化合物不能使酸性高锰酸钾溶液褪色 |
3.有机物分子中的原子(团)之间会相互影响,导致相同的原子(团)表现出不同的性质.下列现象不能说明上述观点的是( )
| A. | 苯酚与溴水可以直接反应,而苯与液溴反应则需要铁作催化剂 | |
| B. | 乙烯能与溴水发生加成反应,而乙烷不能与溴水发生加成反应 | |
| C. | 甲苯能使酸性KMnO4溶液褪色,而甲基环己烷不能使酸性KMnO4溶液褪色 | |
| D. | 苯酚可以与NaOH反应,而乙醇不能与NaOH反应 |
20.已知FeCl2溶液和KI溶液能发生如下反应:2FeCl3+2KI=2FeCl2+2KCl+I2,该反应属于( )
| A. | 化合反应 | B. | 置换反应 | C. | 复分解反应 | D. | 氧化还原反应 |
17.下列离子方程式书写错误的是( )
| A. | 石灰石溶于稀盐酸:CaCO3+2H+═CO2↑+Ca2++H2O | |
| B. | 钠与冷水反应:Na+2H2O═Na++OH-+H2↑ | |
| C. | 铁与稀盐酸反应:Fe+2H+═H2↑+Fe2+ | |
| D. | 铝粉与氢氧化钠溶液反应:2Al+2H2O+2OH-═2AlO2-+3H2↑ |
18.下列说法不正确的是( )
| A. | 食品保存在冰箱中不易坏,说明温度对反应速率有影响 | |
| B. | 在金属与非金属的分界线附近寻找半导体材料 | |
| C. | 在周期表中,第IA族全部为金属元素 | |
| D. | 金刚石与石墨互为同素异形体 |
 ;
;