题目内容
11.25℃时,下列溶液中微粒的物质的量浓度关系正确的是( )| A. | 0.1 mol•L-1NaHC2O4溶液(pH=5.5):c(Na+)>c(HC2O4-)>c(H2C2O4)>c(C2O42-) | |
| B. | 0.1 mol•L-1NaHS溶液:c(OH-)+c(S2-)=c(H+)+c(H2S) | |
| C. | 0.1 mol•L-1 NH4HSO4溶液中滴加0.1 mol•L-1 NaOH溶液至中性:c(Na+)>c(SO42-)>c(NH4+)>c(OH-)=c(H+) | |
| D. | 0.1 mol•L-1CH3COOH溶液和0.1 mol•L-1CH3COONa溶液等体积混合:c(Na+)>c(CH3COOH)>c(CH3COO-)>c(H+)>c(OH-) |
分析 A.NaHC2O4溶液的pH=5.5,说明HC2O4-的电离程度大于其水解程度,则c(C2O42-)>c(H2C2O4);
B.根据硫氢化钠溶液中的质子守恒判断;
C.当二者按照1:1混合时生成硫酸钠、硫酸铵,溶液呈酸性,则氢氧化钠稍过量,结合电荷守恒判断;
D.醋酸的电离程度大于醋酸根离子的水解程度,则c(CH3COO-)>cc(CH3COOH),结合物料守恒可知c(CH3COO-)>c(Na+)>c(CH3COOH).
解答 解:A.0.1 mol•L-1NaHC2O4溶液(pH=5.5),溶液呈酸性,说明HC2O4-的电离程度大于其水解程度,则c(C2O42-)>c(H2C2O4),正确的浓度大小为:c(Na+)>c(HC2O4-)>c(C2O42-)>c(H2C2O4),故A错误;
B.0.1 mol•L-1NaHS溶液中,根据质子守恒可得:c(OH-)+c(S2-)=c(H+)+c(H2S),故B正确;
C.0.1 mol•L-1 NH4HSO4溶液中滴加0.1 mol•L-1 NaOH溶液至中性,则c(OH-)=c(H+),根据电荷守恒可知:c(Na+)+c(NH4+)=c(SO42-),由于铵根离子部分水解,则c(SO42-)>c(NH4+),所以c(Na+)>c(SO42-),溶液中离子浓度大小为:c(Na+)>c(SO42-)>c(NH4+)>c(OH-)=c(H+),故C正确;
D.0.1 mol•L-1CH3COOH溶液和0.1 mol•L-1CH3COONa溶液等体积混合,由于醋酸的电离程度大于醋酸根离子的水解程度,则c(CH3COO-)>cc(CH3COOH),结合物料守恒可知c(CH3COO-)>c(Na+)>c(CH3COOH),溶液中正确的浓度大小为:c(CH3COO-)>c(Na+)>c(CH3COOH)>c(H+)>c(OH-),故D错误;
故选BC.
点评 本题考查了离子浓度大小比较,题目难度中等,明确盐的水解原理原理及其影响为解答关键,注意掌握电荷守恒、物料守恒、质子守恒的含义及应用方法,试题培养了学生的灵活应用能力.


| A. | A~B段和C~D段发生的反应相同 | |
| B. | B~C段反应的离子方程式是 A1O2-+2H2O+CO2═Al(OH)3↓+HCO3- | |
| C. | V=134.4L,n=3mol | |
| D. | D点所得溶液中离子浓度关系为c(K+)>c(CO${\;}_{3}^{2-}$)>c(OH-)>c(HCO${\;}_{3}^{-}$)>c(H+) |
| A. | 合理使用化肥可以提高农作物的产量 | |
| B. | 二氧化氯、臭氧均可用作自来水消毒剂 | |
| C. | 氢氧化铝和碳酸钠均可用于治疗胃酸过多 | |
| D. | 化妆品中的甘油可起到保湿滋润皮肤的作用 |
 一定条件下,下列各组物质能一步实现图所示转化关系的是( )
一定条件下,下列各组物质能一步实现图所示转化关系的是( )| 选项 | X | Y | Z | W |
| A | Al | Al2O3 | NaAlO2 | Al(OH)3 |
| B | Fe3O4 | Fe | FeCl2 | FeCl3 |
| C | H2SO4 | SO2 | S | SO3 |
| D | CH3CH2Br | CH2═CH2 | C2H5OH | CH2BrCH2Br |
| A. | A | B. | B | C. | C | D. | D |
| A. | a、b试管中液体不分层,溶液均为无色 | |
| B. | c、d试管中液体分层,c试管中有机层在下,呈红棕色;d试管中有机层在上,呈红棕色 | |
| C. | a试管中有机层在下,为无色,水层在上,为无色;d试管中有机层在下,呈红棕色 | |
| D. | 以上描述均不正确 |
| A. | 若Vl=V2,且混合溶液pH<7,则必有c1<c2 | |
| B. | 若混合溶液的pH=7,则混合溶液中c(Na+)=c (CH3COO-)+c(CH3COOH ) | |
| C. | 若混合溶液的pH>7,则混合溶液中c(Na+)<c( CH3COO-) | |
| D. | 若Vl=V2,c1=c2,则混合溶液中c(OH-)=c(CH3COOH)+c(H+) |
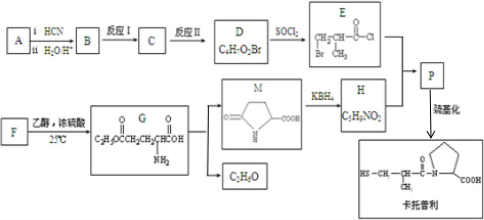
 (R1、R2为烃基)
(R1、R2为烃基)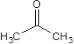 .
. ,反应Ⅱ所用试剂是HBr.
,反应Ⅱ所用试剂是HBr. .
.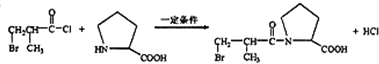 .
. (任写一种).
(任写一种).