题目内容
16.NA表示阿伏加德罗常数,下列有关叙述正确的是( )①1mol苯乙烯中含有的碳碳双键数为4NA
②6.2g氧化钠和7.8g过氧化钠的混合物中含有的离子总数为0.6NA
③3.4gNH3中含N-H键数目为0.2NA
④常温下1L 0.5mol/L NH4Cl溶液与2L 0.25mol/L NH4Cl溶液所含NH4+的数目相同
⑤常温下4.6gNO2和N2O4混合气体中所含原子总数为0.3NA
⑥等体积、浓度均为1mol/L的磷酸和盐酸,电离出的氢离子数之比为3:1
⑦1mol铁粉在1mol氯气中充分燃烧,失去的电子数为3NA
⑧高温下,16.8g Fe与足量水蒸气完全反应失去0.8NA个电子.
| A. | ①④⑦ | B. | ②⑤⑧ | C. | ②③④⑥ | D. | ①②④⑤⑦ |
分析 ①苯环中不含碳碳双键;
②过氧化钠中阴离子为过氧根离子,氧化钠与过氧化钠的物质的量都是0.1mol氧化钠和0.1mol过氧化钠中含有0.6mol阴阳离子;
③质量换算物质的量结合氨气分子结构分析计算;
④NH4+发生水解,NH4+浓度越小水解程度越大;
⑤NO2和N2O4的最简式均为NO2;
⑥磷酸为弱电解质,不能完全电离出氢离子;
⑦1mol氯气与1mol铁粉反应,氯气不足,完全反应只能得2mol电子;
⑧n=$\frac{m}{M}$计算得到物质的量,结合铁和水蒸气反应生成四氧化三铁和氢气,计算电子转移数.
解答 解:①1mol苯乙烯中含有的碳碳双键数为1NA,故错误;
②6.2g氧化钠的物质的量为0.1mol,含有0.2mol钠离子、0.1mol阴离子,总共含有0.3mol离子;7.8g过氧化钠的物质的量为0.1mol,含有0.2mol钠离子、0.1mol过氧根离子,总共含有0.3mol离子,二者的混合物中含有0.6mol离子,含有的离子总数为0.6NA,故正确;
③3.4gNH3 物质的量=$\frac{3.4g}{17g/mol}$=0.2mol,含N-H键数目为0.6NA,故错误;
④浓度越大水解程度越小,1L 0.50mol•L-1 NH4Cl溶液与2L 0.25mol•L-1 NH4Cl溶液含NH4+物质的量后者小,故错误;
⑤NO2和N2O4的最简式均为NO2,故4.6g混合物中含有的NO2的物质的量为0.1mol,故含0.1mol氮原子和0.2mol氧原子,共含有原子数为0.3NA个,故正确;
⑥盐酸为强电解质,溶液中完全电离,1mol/L的盐酸中含有氢离子浓度为1mol/L,而磷酸为弱电解质,1mol/L的磷酸溶液中氢离子浓度小于3mol/L,所以电离出的氢离子数之比小于3:1,故B误;
⑦1mol氯气与1mol铁粉反应,氯气不足,完全反应只能得2mol电子,故错误;
⑧n=$\frac{m}{M}$计算得到物质的量=$\frac{16.8g}{56g/mol}$=0.3mol,结合铁和水蒸气反应生成四氧化三铁和氢气计算电子转移数,3Fe~Fe3O4~8e-,则Fe与足量水蒸气完全反应失去0.8NA个电子,故正确;
故选:B.
点评 本题考查了阿伏伽德罗常数的分析应用,熟练掌握公式的使用和物质的结构是解题关键,注意氧化还原反应电子转移计算,注意物质的量和微粒数的计算应用,题目难度中等.

 直通贵州名校周测月考直通名校系列答案
直通贵州名校周测月考直通名校系列答案| A. | 若X为氧化物,则Y也一定是氧化物 | |
| B. | 若M为金属单质,则N一定为金属单质 | |
| C. | 若X是不含金属元素的化合物,则N一定是非金属单质 | |
| D. | 若X是含有金属元素的化合物,则Y一定含有金属元素的化合物 |
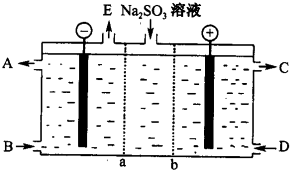
 H2S利用是回收能量并得到单质硫.反应原理为:2H2S(g)+02(g)=S2(s)+2H20(1)△H=-632kJ•mol-1.图为质子膜H2S燃料电池示意图.下列说法正确的是( )
H2S利用是回收能量并得到单质硫.反应原理为:2H2S(g)+02(g)=S2(s)+2H20(1)△H=-632kJ•mol-1.图为质子膜H2S燃料电池示意图.下列说法正确的是( )| A. | 该电池可实现把化学能全部转化为电能 | |
| B. | 电极b上发生的电极反应为:02+2H2O+4e-=40H- | |
| C. | 电极a上发生的电极反应为:2H2S-4e-=S2+4H+ | |
| D. | 标况下,当有22.4LH2S参与反应时,有2mo1H+经质子膜进入负极区 |
| A. | pH=1的溶液中:Na+、NH4+、SO42-、CO32- | |
| B. | 与铝反应产生大量氢气的溶液中:Ca2+、Fe2+、Cl-、NO3- | |
| C. | $\frac{c(O{H}^{-})}{c({H}^{+})}$=10-6的溶液中:K+、Na+、I-,SO42- | |
| D. | c(ClO-)=1.0 mol•L-1的溶液中:Na+、K+、S2-、SO42- |
| A. | 0.1 mol•L-1NaHC2O4溶液(pH=5.5):c(Na+)>c(HC2O4-)>c(H2C2O4)>c(C2O42-) | |
| B. | 0.1 mol•L-1NaHS溶液:c(OH-)+c(S2-)=c(H+)+c(H2S) | |
| C. | 0.1 mol•L-1 NH4HSO4溶液中滴加0.1 mol•L-1 NaOH溶液至中性:c(Na+)>c(SO42-)>c(NH4+)>c(OH-)=c(H+) | |
| D. | 0.1 mol•L-1CH3COOH溶液和0.1 mol•L-1CH3COONa溶液等体积混合:c(Na+)>c(CH3COOH)>c(CH3COO-)>c(H+)>c(OH-) |
| A. | 1molMgCl2 | B. | 3molKClO3 | C. | 1molAlCl3 | D. | 1.5molCaCl2 |
| A. | 蔗糖遇浓硫酸可发生碳化现象,但与稀硫酸则不会发生反应 | |
| B. | 因为纤维素结构中有羟基,所以它能与醋酸发生酯化反应,生成乙酸纤维素酯 | |
| C. | 除去淀粉中的葡萄糖杂质,可用加水渗析的方法 | |
| D. | 将淀粉与水在酸作用下加热水解,在滴入碘酒不变蓝时表示水解完全,即可停止加热 |
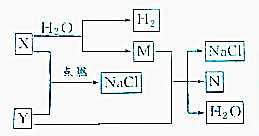 已知下列转化关系:
已知下列转化关系: