题目内容
1.标况下将CO2气体缓缓地通入到含2mol KOH、1mol Ba(OH)2和2mol KAlO2的混合溶液中直至过量,生成沉淀的物质的量与所通CO2的体积关系如图所示.下列关于整个反应进程中的各种描述正确的是( )
| A. | A~B段和C~D段发生的反应相同 | |
| B. | B~C段反应的离子方程式是 A1O2-+2H2O+CO2═Al(OH)3↓+HCO3- | |
| C. | V=134.4L,n=3mol | |
| D. | D点所得溶液中离子浓度关系为c(K+)>c(CO${\;}_{3}^{2-}$)>c(OH-)>c(HCO${\;}_{3}^{-}$)>c(H+) |
分析 只要通入CO2,立刻就有沉淀BaCO3产生,首先发生反应Ba(OH)2+CO2=BaCO3↓+H2O,将Ba(OH)2消耗完毕,接下来消耗KOH,发生反应2KOH+CO2=K2CO3+H2O,因而此段沉淀的量保持不变,然后沉淀量增大,发生反应2AlO2-+3H2O+CO2=2Al(OH)3↓+CO32-,沉淀量达最大后,再发生CO32-+CO2+H2O=2HCO3-,最后发生反应BaCO3+CO2+H2O=Ba(HCO3)2,沉淀部分溶解,以此来解答.
解答 解:OA段:通入CO2后立刻就有沉淀BaCO3产生,首先发生反应为:Ba(OH)2+CO2=BaCO3↓+H2O,
AB段:Ba(OH)2消耗完毕后,接下来消耗KOH,发生反应为:2KOH+CO2=K2CO3+H2O,因而此段沉淀的量保持不变,
BC段:然后沉淀量增大,发生反应2AlO2-+3H2O+CO2=2Al(OH)3↓+CO32-,
CD段:沉淀量达最大后,再发生CO32-+CO2+H2O=2HCO3-,
DE段:最后发生反应BaCO3+CO2+H2O=Ba(HCO3)2,沉淀部分溶解,
A.由上述分析可知,A~B段发生2KOH+CO2=K2CO3+H2O,离子方程式2OH-+CO2═CO32-+H2O,C~D段发生CO32-+CO2+H2O=HCO3-,两阶段反应不相同,故A错误;
B.BC段沉淀量增大,发生反应为:2AlO2-+3H2O+CO2=2Al(OH)3↓+CO32-,故B错误;
C.E点溶质为碳酸氢钾和Ba(HCO3)2,根据质量守恒,钾离子的总物质的量为2mol+2mol=4mol,钡离子的物质的量为1mol,根据C元素混合可知消耗二氧化碳的物质的量为:4mol+1mol×2=6mol,标准状况下6mol二氧化碳的体积为:22.4L/mol×6mol=134.4L;n为碳酸钡和氢氧化铝的总物质的量,根据质量守恒可知n=1+2=3,故C正确;
D.D点溶质为KHCO3,则c(HCO3-)>c(OH-)>c(CO32-),故D错误;
故选C.
点评 本题以图象题形式考查混合物反应的计算,为高频考点,题目难度中等,侧重对基础知识的综合考查,把握元素化合物性质及发生的反应、图象与反应的对应关系是关键的关键.

| A. | CH2Cl2 | B. | C4H9Cl | C. | C4H10 | D. | C3H6 |

| A. | M分子中所有碳原子可能处在同一个平面上 | |
| B. | 1molM与浓溴水反应时最多消耗2molBr2 | |
| C. | M可以发生加成、加聚、氧化、还原、消去等反应 | |
| D. | M可以与Na、NaOH溶液、Na2CO3溶液反应 |
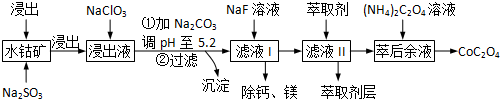
己知:,①浸出液含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Ca2+、Mg2+、Al3+等;
②部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 | Mn(OH)2 |
| 完全沉淀的pH | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
(2)NaClO3可将Fe2+氧化为Fe3+离子.可用氯气通入到热的浓氢氧化钠溶液来制取NaClO3.实验需要制取10.65克NaClO3,需要的氯气由电解食盐水生成,若不考虑反应过程中的损失,则同时生成的氢气的体积为6.72L(标准状况下).
(3)萃取剂对金属离子的萃取率与pH的关系如下图所示.使用萃取剂最适宜的pH是B(填选项序号).
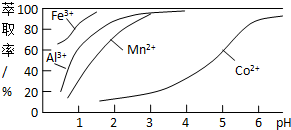
A.接近2.0 B.接近3.0 C.接近5.0
(4)“除钙、镁”是将溶液中Ca2+与Mg2+转化为MgF2、CaF2沉淀.已知某温度下,Ksp(MgF2)=7.35×10-11,Ksp(CaF2)=1.05×10-10.当加入过量NaF后,所得滤液c(Mg2+)/c(Ca2+)=0.7.
(5)为测定制得的无水草酸钴样品的纯度,现称取样品mg,先用适当试剂将其转化,得到纯净的草酸铵溶液,再用过量的稀硫酸酸化,用c mol/L高锰酸钾溶液去滴定,当溶液由无色变为浅紫色(或紫红色),且半分钟内不变色时(填颜色变化),共用去高锰酸钾溶液VmL,计算草酸钴样品的纯度为36.75cv/m%.
| A. | 若X为氧化物,则Y也一定是氧化物 | |
| B. | 若M为金属单质,则N一定为金属单质 | |
| C. | 若X是不含金属元素的化合物,则N一定是非金属单质 | |
| D. | 若X是含有金属元素的化合物,则Y一定含有金属元素的化合物 |
| A. | CH2=CH-CN | B. |  | C. |  | D. | (CH3)3C-CH2-C≡CH |
| X | Y | ||
| Z | W | Q |
| A. | Y 的非金属性比Q强,所以HnY的酸性比HnQ强 | |
| B. | ZX2、WX2的熔沸点、硬度相差很大,这是由于它们的化学键类型不同造成的 | |
| C. | W、Q、Y 元素的原子半径及其简单离子半径依次减小 | |
| D. | 将足量的 X 单质通入 W 的氢化物的水溶液,能得到 W 的低价氧化物 |
| A. | 0.1 mol•L-1NaHC2O4溶液(pH=5.5):c(Na+)>c(HC2O4-)>c(H2C2O4)>c(C2O42-) | |
| B. | 0.1 mol•L-1NaHS溶液:c(OH-)+c(S2-)=c(H+)+c(H2S) | |
| C. | 0.1 mol•L-1 NH4HSO4溶液中滴加0.1 mol•L-1 NaOH溶液至中性:c(Na+)>c(SO42-)>c(NH4+)>c(OH-)=c(H+) | |
| D. | 0.1 mol•L-1CH3COOH溶液和0.1 mol•L-1CH3COONa溶液等体积混合:c(Na+)>c(CH3COOH)>c(CH3COO-)>c(H+)>c(OH-) |