题目内容
20.用黄铁矿可以制取硫酸,再用硫酸制取化肥硫酸铵,燃烧含FeS2为80%的黄铁矿75t,生产出79.2t硫酸铵,若在制取硫酸铵时硫酸的利用率为90%,则用黄铁矿制取硫酸时的损失率为33.3%.分析 根据S元素守恒,可得关系式为:FeS2~2SO2~2SO3~2H2SO4~2(NH4)2SO4,将每一步的损失率、利用率都归为FeS2的利用率结合关系式计算.
解答 解:设用黄铁矿制取硫酸时的损失率为a,则:
FeS2~2SO2~2SO3~2H2SO4~2(NH4)2SO4
120 264
75t×80%×(1-a)×90% 79.2t
所以120:264=75t×80%×(1-a)×90%:79.2t
解得a=33.3%
故答案为:33.3%.
点评 本题考查多步反应有损失率的计算,而对多步反应计算常利用关系式进行解答,关键理解中间产物的损耗量(或转化率、利用率)都可归为起始原料的损耗量(或转化率、利用率),元素的损失率等于该化合物的损失率,难度中等.

练习册系列答案
 初中学业考试导与练系列答案
初中学业考试导与练系列答案
相关题目
10.短周期元素 X、Y、Z、W、Q 在周期表中相对位置如图所示,已知 X 元素是地壳中含量最高的元素,下列说法正确的是( )
| X | Y | ||
| Z | W | Q |
| A. | Y 的非金属性比Q强,所以HnY的酸性比HnQ强 | |
| B. | ZX2、WX2的熔沸点、硬度相差很大,这是由于它们的化学键类型不同造成的 | |
| C. | W、Q、Y 元素的原子半径及其简单离子半径依次减小 | |
| D. | 将足量的 X 单质通入 W 的氢化物的水溶液,能得到 W 的低价氧化物 |
11.25℃时,下列溶液中微粒的物质的量浓度关系正确的是( )
| A. | 0.1 mol•L-1NaHC2O4溶液(pH=5.5):c(Na+)>c(HC2O4-)>c(H2C2O4)>c(C2O42-) | |
| B. | 0.1 mol•L-1NaHS溶液:c(OH-)+c(S2-)=c(H+)+c(H2S) | |
| C. | 0.1 mol•L-1 NH4HSO4溶液中滴加0.1 mol•L-1 NaOH溶液至中性:c(Na+)>c(SO42-)>c(NH4+)>c(OH-)=c(H+) | |
| D. | 0.1 mol•L-1CH3COOH溶液和0.1 mol•L-1CH3COONa溶液等体积混合:c(Na+)>c(CH3COOH)>c(CH3COO-)>c(H+)>c(OH-) |
8.含有的Cl-个数与3molNaCl含有的Cl-个数相同的物质是( )
| A. | 1molMgCl2 | B. | 3molKClO3 | C. | 1molAlCl3 | D. | 1.5molCaCl2 |
15.氯酸钾、火药及磷组成的混合物极易爆炸.由于KClO3受热分解释放出O2,引发白磷(P4,固体)的燃烧而导致火药爆炸.31gP4完全燃烧生成五氧化二磷固体释放出akJ热量.下列说法不正确的是( )
| A. | KClO3的分解过程中只有共价键断裂没有共价键生成 | |
| B. | 火药爆炸会使周围空气体积迅速膨胀 | |
| C. | 若白磷完全燃烧释放出8akJ热量,则需要标准状况下的O2体积为224L | |
| D. | 易燃易爆物应远离火源 |
12.关于自发过程的叙述,正确的是( )
| A. | 其逆过程在相同条件下也必定是自发的 | |
| B. | 其逆过程在相同条件下也可能是自发的 | |
| C. | 其逆过程在其他条件下也可能是自发的 | |
| D. | 自发过程与外界条件无关 |
16.下列事实能说明醋酸是弱电解质的是( )
①醋酸与水以任意比例互溶
②醋酸溶液能导电
③醋酸溶液中存在醋酸分子④测得醋酸的pH比盐酸pH大
⑤在漂白剂溶液中滴加醋酸能增强漂白效果
⑥0.1mol/L醋酸溶液的pH=2
⑦CH3COOK溶液能使酚酞试液变红色
⑧大小相同的锌粒与相同物质的量浓度的盐酸和醋酸反应,醋酸产生氢气速率慢.
①醋酸与水以任意比例互溶
②醋酸溶液能导电
③醋酸溶液中存在醋酸分子④测得醋酸的pH比盐酸pH大
⑤在漂白剂溶液中滴加醋酸能增强漂白效果
⑥0.1mol/L醋酸溶液的pH=2
⑦CH3COOK溶液能使酚酞试液变红色
⑧大小相同的锌粒与相同物质的量浓度的盐酸和醋酸反应,醋酸产生氢气速率慢.
| A. | ①④⑥⑧ | B. | ②④⑥⑦ | C. | ④⑤⑥⑧ | D. | ③⑥⑦⑧ |
17.下列说法不正确的是( )
| A. | 除去MgCl2溶液中混有的少量FeCl3,可加入足量的Mg(OH)2粉末搅拌后过滤 | |
| B. | 在KI溶液中加人氯化银,一段时间后沉淀变成黄色,说明同温度下Kap(AgI)<Kap(AgCl) | |
| C. | 用强酸滴定强碱时,若选用甲基橙作指示剂,当达到滴定终点时溶液的颜色变化是由黄色变橙色 | |
| D. | 足量锌分别和等体积、等物质的量浓度的硝酸和醋酸反应时产生H2的量相等,放出H2的速率不等 |
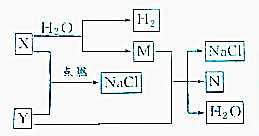 已知下列转化关系:
已知下列转化关系: