题目内容
6.NA表示阿伏加德罗常数的值,下列说法正确的是( )| A. | 30gSiO2晶体中含有NA个硅氧键 | |
| B. | 常温常压下,11.2LCl2含有的分子数目少于0.5NA | |
| C. | 25℃时,pH=12的NaOH溶液含有的OH-数目为0.01NA | |
| D. | 50mL18.4mol/L浓硫酸与足量铜微热,生成SO2分子的数目为0.46NA |
分析 A.1molSiO2晶体含有4mol的硅氧键;
B.常温常压Vm大于22.4L/mol;
C.溶液体积未知;
D.铜只与浓硫酸反应,与稀硫酸不反应;
解答 解:A.30gSiO2晶体物质的量为$\frac{30g}{60g/mol}$=0.5mol,含有硅氧键数为0.5mol×4×NA=2NA,故A错误;
B.常温常压Vm大于22.4L/mol,所以11.2LCl2含有氯气分子的物质的量小于0.5mol,含有的分子数目少于0.5NA,故B正确;
C.溶液体积未知,无法计算氢氧根子数目,故C错误;
D.随着反应进行,硫酸浓度变稀,与铜将不再反应,生成二氧化硫小于0.46mol,故D错误;
故选:B.
点评 本题考查阿伏伽德罗常数的计算与判断,题目难度中等,涉及知识点较多、综合性较强,充分考查学生的分析、理解能力及灵活应用基础知识的能力,注意熟练掌握物质的量与阿伏伽德罗常数、摩尔质量等物理量之间的关系.

练习册系列答案
相关题目
16.已知反应:
①2CH3OH(g)?CH3OCH3(g)+H2O(g)△H1=-23.9kJ/mol
②2CH3OH(g)═C2H4(g)+2H2O(g)△H2=-29.1kJ/mol
③CH3CH2OH(g)═CH3OCH3(g)△H3=+50.7kJ/mol
在C2H4(g)+H2O(g)=CH3CH2OH(g)△H4中,△H4等于( )
①2CH3OH(g)?CH3OCH3(g)+H2O(g)△H1=-23.9kJ/mol
②2CH3OH(g)═C2H4(g)+2H2O(g)△H2=-29.1kJ/mol
③CH3CH2OH(g)═CH3OCH3(g)△H3=+50.7kJ/mol
在C2H4(g)+H2O(g)=CH3CH2OH(g)△H4中,△H4等于( )
| A. | -48.5kJ/mol | B. | +48.5kJ/mol | C. | -45.5kJ/mol | D. | +45.5kJ/mol |
17.以NA表示阿佛加德罗常数,下列说法中正确的是( )
| A. | 78g过氧化钠中含2NA个O2- | |
| B. | 0.1molOH-含NA个电子 | |
| C. | 1.8g重水(D2O)中含NA个中子 | |
| D. | 标准状况下11.2L臭氧中含NA个氧原子 |
14.设NA为阿伏伽德罗常数的值,下列叙述正确的是( )
| A. | 在100 g质量分数为30%的甲醛水溶液中,含有氢原子数为2NA | |
| B. | 7.8 g Na2S和Na2O2固体混合物中,含有的阴离子数为0.1NA | |
| C. | 1mol乙醇含有共价键的总数7NA | |
| D. | 反应2SO2(g)+O2(g)?2 SO3 (g),单位时间内消耗NA个O2分子的同时生成2NA个SO3分子,此时反应达到平衡状态 |
1.下列说法正确的是( )
| A. | 3C(s)+CaO(s)═CaC2(s)+CO(g)在常温下不能自发进行,说明该反应的△H>0 | |
| B. | 0.1mol/L氨水加水稀释后,溶液中$\frac{c(O{H}^{-})}{c(N{{H}_{3}•{H}_{2}O}_{\;})}$的值减小 | |
| C. | 常温常压下,22.4L Cl2中含有的分子数为6.02×1023个 | |
| D. | 合成氨时,其他条件不变,升高温度,氢气的反应速率和平衡转化率均增大 |
18.NA代表阿伏加德罗常数的值.下列叙述正确的是( )
| A. | 9 g超重水(3H216O)含中子数为6NA | |
| B. | 标准状况下,22.4 L CCl4含有的分子数目为NA | |
| C. | 常温常压下,16g甲烷中共价键数目为4NA | |
| D. | 1 L 0.1 mol•L-1的NaHCO3溶液中HCO3-和CO32-离子数之和为0.1 NA |
15.下列操作或装置能达到实验目的是( )
| A. | 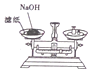 称取一定量的NaOH | |
| B. | 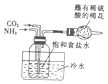 制取NaHCO3 | |
| C. | 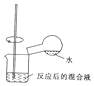 检验浓硫酸与铜反应后的产物中是否含有铜离子 | |
| D. | 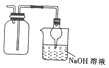 收集NO2丙防止其污染环境 |
7.下列离子方程式中不正确的是( )
| A. | 氢氧化钡溶液和硫酸钠溶液混合:Ba2++SO42-=BaSO4↓ | |
| B. | 将亚硫酸氢钠加入盐酸溶液中:HSO3-+H+=SO2↑+H2O | |
| C. | 氢硫酸与亚硫酸混合:H2SO3+2H2S=3S↓+3H2O | |
| D. | H2S气体通入CuSO4溶液中:Cu2++S2-=CuS↓ |
