题目内容
14.设NA为阿伏伽德罗常数的值,下列叙述正确的是( )| A. | 在100 g质量分数为30%的甲醛水溶液中,含有氢原子数为2NA | |
| B. | 7.8 g Na2S和Na2O2固体混合物中,含有的阴离子数为0.1NA | |
| C. | 1mol乙醇含有共价键的总数7NA | |
| D. | 反应2SO2(g)+O2(g)?2 SO3 (g),单位时间内消耗NA个O2分子的同时生成2NA个SO3分子,此时反应达到平衡状态 |
分析 A.甲醛溶液中的水分子中也含有氢原子;
B.硫化钠和过氧化钠的摩尔质量相同,二者化学式中都含有1个阴离子;
C.乙醇分子中含有8个共价键;
D.位时间内消耗NA个O2分子的同时生成2NA个SO3分子,表示的都是正反应,无法判断平衡状态.
解答 解:A.在100g质量分数为30%的甲醛水溶液中含有30g甲醛,含有甲醛的物质的量为1mol,1mol甲醛分子中含有2mol氢原子,由于水分子中也含有氢原子,则该溶液中含有氢原子数大于2NA,故A错误;
B.7.8 g Na2S和Na2O2固体混合物中含有的总物质的量为:$\frac{7.8g}{78g/mol}$=0.1mol,0.1mol二者的混合物中含有0.1mol阴离子,含有的阴离子数为0.1NA,故B正确;
C.1mol乙醇含有5mol碳氢键、1mol碳碳键、1mol碳氧键和1molO-H键,总共含有8mol共价键,含有共价键的总数8NA,故B错误;
D.反应2SO2(g)+O2(g)?2 SO3 (g),单位时间内消耗NA个O2分子的同时生成2NA个SO3分子,表示的都是正反应,无法判断正逆反应速率是否相等,故D错误;
故选B.
点评 本题考查阿伏加德罗常数的应用,题目难度中等,注意掌握以物质的量为中心的各化学量与阿伏加德罗常数的关系,准确弄清分子、原子、原子核内质子中子及核外电子的构成关系.

练习册系列答案
相关题目
4.对某澄清透明溶液进行离子检验,实验结果如下,其中明显错误的是( )
| A. | K+、Cu2+、Cl-、NO3- | B. | K+、Na+、OH-、CO32- | ||
| C. | Na+、Mg2+、Cl-、SO42- | D. | OH-、NO3-、Fe2+、Na+ |
5.下列物质分类正确的是( )
| A. | Na2O2、Fe3O4、CuO均为碱性氧化物 | B. | 盐酸、水玻璃、氨水均为混合物 | ||
| C. | 烧碱、冰醋酸、四氯化碳均为电解质 | D. | 稀豆浆、硅酸、氯化铁溶液均为胶体 |
9.石墨和金刚石都是碳的单质,金刚石在一定条件下可以转化为石墨.已知12g金刚石完全转化为石墨时,要放收a kJ的能量.下列说法中正确的是( )
①石墨不如金刚石稳定
②金刚石不如石墨稳定
③等质量的石墨和金刚石完全燃烧,金刚石放出的能量多
④等质量的石墨和金刚石完全燃烧,石墨放出的能量多
⑤石墨能量低 ⑥金刚石能量高.
①石墨不如金刚石稳定
②金刚石不如石墨稳定
③等质量的石墨和金刚石完全燃烧,金刚石放出的能量多
④等质量的石墨和金刚石完全燃烧,石墨放出的能量多
⑤石墨能量低 ⑥金刚石能量高.
| A. | ①②⑥ | B. | ②③⑥ | C. | ①④⑥ | D. | ③④⑥ |
19.设NA表示阿伏伽德罗常数的值,下列说法不正确的是( )
| A. | 4.0g 氦气中含有的最外层电子数为4NA | |
| B. | 3.9g 2H37Cl中含有的中子数为2.1NA | |
| C. | 标准状况下,11.2L丙烷中含有的非极性键数目为NA | |
| D. | 100mL 1mol•L-1 CH3COOH溶液中含有的分子数目大于0.1NA |
6.NA表示阿伏加德罗常数的值,下列说法正确的是( )
| A. | 30gSiO2晶体中含有NA个硅氧键 | |
| B. | 常温常压下,11.2LCl2含有的分子数目少于0.5NA | |
| C. | 25℃时,pH=12的NaOH溶液含有的OH-数目为0.01NA | |
| D. | 50mL18.4mol/L浓硫酸与足量铜微热,生成SO2分子的数目为0.46NA |
3.下列有关实验操作、现象、解释或结论都正确的是( )
| 选项 | 实验操作 | 现象 | 解释或结论 |
| A | 充分吸收了Na2SiO3饱和溶液的小木条,沥干后放在酒精灯外焰加热 | 小木条不燃烧 | Na2SiO3可能防火剂 |
| B | 将H2在充满Cl2的集气瓶中燃烧 | 集气瓶口上方有白烟生成 | H2、Cl2化合生成HCl |
| C | 将SO2通入酸性高锰酸钾溶液中 | 溶液褪色 | SO2具有漂白性 |
| D | 除去表面氧化膜的铝箔,在酒精灯上充分加热 | 铝不能滴落下来 | 铝熔点高,没能熔化 |
| A. | A | B. | B | C. | C | D. | D |
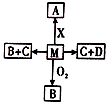 已知M、A、B、C、D、X六种物质都是中学化学的常见物质,它们的转化关系如右图所示(某些反应物或者反应条件没有标出).
已知M、A、B、C、D、X六种物质都是中学化学的常见物质,它们的转化关系如右图所示(某些反应物或者反应条件没有标出).