题目内容
11.氯化铵、甲醇、氧化铝都是重要化合物.(1)已知:
I NH4Cl(s)=NH3(g)+HCl(g)△H=+l63.9kJ•mol-1
II HCl(g)+CH3OH(g)?CH3Cl(g)+H2O(g)△H=-31.9kJ•mol-1
III NH4Cl(s)+CH3OH(g)?NH3(g)+CH3Cl(g)+H2O(g)
①反应III在较高温度条件下能自发反应(填“较高温度”、“较低温度”或“任何温度”),理由是因为反应Ⅲ的△S>0,△H>0.
②图1是反应III使用三种不同催化剂时得到的CH3Cl产率与温度关系的变化图.
己知:催化剂用量、催化剂粒数、n(甲醇):n(氯化铵)的值、甲醇进料速度、反应时间等测试条件都相同.

图1 中a曲线CH3Cl产率先增大后减小的原因是温度越高反应速率越快,因此随着温度升高,CH3Cl产率逐渐增大,410℃之后,随着温度升高,催化剂活性降低,反应速率减小,因此CH3Cl产率逐渐减小.请在图2中画出其它条件都相同时,在370℃下使用三种不同催化剂至反应平衡时,CH3Cl的产率与时间关系的变化曲线,并用a、b、c标出对应的曲线.
(2)25℃时,在某浓度的NH4Cl溶液中滴加一定量的氨水至中性,此时测得溶液中c(Cl-)=0.36mol•L-1,则混合溶液中c (NH3•H2O)=2×10-3mol•L-1.(25℃时,NH3•H2O的Kb=1.8×10-5)
(3)多孔Al2O3薄膜可作为催化剂载体、模板合成纳米材料等用途.现以高纯铝片作为阳极,不锈钢作为阴极,一定溶度的磷酸溶液作为电解质进行电解,即可初步制取多孔Al2O3膜.请写出该制取过程的阳极电极反应:2Al+3H2O-6e-=Al2O3+6H+.
分析 (1)①盖斯定律Ⅰ+Ⅱ计算III的焓变结合△G=△H-T△S<0能自发分析判断;
②根据反应速率越大,CH3Cl产率越大结合温度升高,催化剂活性降低,反应速率减小分析;由图1可知三种不同催化剂的效果为c>b>a,所以开始时反应速率为c>b>a,但催化剂不影响平衡状态,则最终平衡状态一样,据此分析;
(2)根据电荷守恒c(NH4+)+c(H+)=c(Cl-)+c(OH-),由于溶液呈中性,则c(H+)=c(OH-)=10-7mol/L,故c(NH4+)=c(Cl-)=0.36mol•L-1,结合NH3.H2O?NH4++OH-的电离常数表达式计算;
(3)阳极为铝失电子发生氧化反应生成Al2O3.
解答 解:(1)①I NH4Cl(s)=NH3(g)+HCl(g)△H=+l63.9kJ•mol-1
II HCl(g)+CH3OH(g)?CH3Cl(g)+H2O(g)△H=-31.9kJ•mol-1
由盖斯定律Ⅰ+Ⅱ得III NH4Cl(s)+CH3OH(g)?NH3(g)+CH3Cl(g)+H2O(g)△H=+l63.9kJ•mol-1-31.9kJ•mol-1=+l32kJ•mol-1,又该反应△S>0,所以根据△G=△H-T△S<0能自发,则反应III在较高温度条件下能自发反应,理由是因为反应Ⅲ的△S>0,△H>0,故答案为:较高温度;因为反应Ⅲ的△S>0,△H>0;
②因为反应速率越大,CH3Cl产率越大,而温度升高,催化剂活性降低,反应速率反而减小,所以图1 中a曲线CH3Cl产率先增大后减小的原因是温度越高反应速率越快,因此随着温度升高,CH3Cl产率逐渐增大,410℃之后,随着温度升高,催化剂活性降低,反应速率减小,因此CH3Cl产率逐渐减小;
由图1可知三种不同催化剂的效果为c>b>a,所以开始时反应速率为c>b>a,但催化剂不影响平衡状态,则最终平衡状态一样,所以a、b、c对应的CH3Cl的产率与时间关系的变化曲线图为: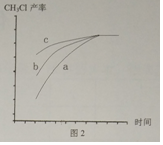 ;
;
故答案为:温度越高反应速率越快,因此随着温度升高,CH3Cl产率逐渐增大,410℃之后,随着温度升高,催化剂活性降低,反应速率减小,因此CH3Cl产率逐渐减小;
(2)电荷守恒c(NH4+)+c(H+)=c(Cl-)+c(OH-),由于溶液呈中性,则c(H+)=c(OH-)=10-7mol/L,故c(NH4+)=c(Cl-)=0.36mol•L-1,又溶液中存在平衡NH3.H2O?NH4++OH-,电离常故Kb=1.8×10-5=$\frac{c(OH{\;}^{-})c(NH{\;}_{4}{\;}^{+})}{c(NH{\;}_{3}•H{\;}_{2}O)}$=$\frac{10{\;}^{-7}×0.36}{c(NH{\;}_{3}•H{\;}_{2}O)}$,所以解得c (NH3•H2O)=2×10-3mol•L-1,故答案为:2×10-3;
(3)阳极为铝失电子发生氧化反应生成Al2O3,电极反应为:2Al+3H2O-6e-=Al2O3+6H+,故答案为:2Al+3H2O-6e-=Al2O3+6H+.
点评 本题考查较综合,涉及盖斯定律、外界条件对化学平衡的影响、弱电解质的电离与计算以及电解池原理等知识点,侧重考查学生分析问题、灵活运用知识解答问题能力,题目难度中等.

| A. | 0.1 mol | B. | 0.2 mol | C. | 0.3 mol | D. | 0.4 mol |
| A. | 4.0g 氦气中含有的最外层电子数为4NA | |
| B. | 3.9g 2H37Cl中含有的中子数为2.1NA | |
| C. | 标准状况下,11.2L丙烷中含有的非极性键数目为NA | |
| D. | 100mL 1mol•L-1 CH3COOH溶液中含有的分子数目大于0.1NA |
| A. | 30gSiO2晶体中含有NA个硅氧键 | |
| B. | 常温常压下,11.2LCl2含有的分子数目少于0.5NA | |
| C. | 25℃时,pH=12的NaOH溶液含有的OH-数目为0.01NA | |
| D. | 50mL18.4mol/L浓硫酸与足量铜微热,生成SO2分子的数目为0.46NA |
| A. | 若A为非金属单质,则D一定为硝酸或硫酸 | |
| B. | 若A为金属单质,则A一定位于第三周期、IA族 | |
| C. | 不论A为单质还是化合物,D都有可能是同一种物质,该物质的浓溶液在常温下都能使铁和铝发生钝化 | |
| D. | 若A是共价化合物,A的水溶液一定能显碱性 |
| 选项 | 实验操作 | 现象 | 解释或结论 |
| A | 充分吸收了Na2SiO3饱和溶液的小木条,沥干后放在酒精灯外焰加热 | 小木条不燃烧 | Na2SiO3可能防火剂 |
| B | 将H2在充满Cl2的集气瓶中燃烧 | 集气瓶口上方有白烟生成 | H2、Cl2化合生成HCl |
| C | 将SO2通入酸性高锰酸钾溶液中 | 溶液褪色 | SO2具有漂白性 |
| D | 除去表面氧化膜的铝箔,在酒精灯上充分加热 | 铝不能滴落下来 | 铝熔点高,没能熔化 |
| A. | A | B. | B | C. | C | D. | D |
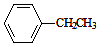 $→_{加热}^{Fe_{2}O_{3}}$
$→_{加热}^{Fe_{2}O_{3}}$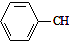 =CH2+H2,下列说法正确的是( )
=CH2+H2,下列说法正确的是( )| A. | 酸性高锰酸钾溶液和溴水都可以用来鉴别乙苯和苯乙烯 | |
| B. | 乙苯、苯乙烯均能发生取代反应、加聚反应,氧化反应 | |
| C. | 乙苯的一氯取代产物有共有5种 | |
| D. | 乙苯和苯乙烯分子内共平面的碳原子数最多均为7 |
| A. | 4HNO3$\frac{\underline{\;光照\;}}{\;}$2H2O+4H2O↑+O2↑ | B. | NaOH+HCl═NaCl+H2O | ||
| C. | CaCO3+2HCl═CaCl2+CO2↑+H2 | D. | 2H2+O2$\frac{\underline{\;点燃\;}}{\;}$2H2O |
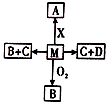 已知M、A、B、C、D、X六种物质都是中学化学的常见物质,它们的转化关系如右图所示(某些反应物或者反应条件没有标出).
已知M、A、B、C、D、X六种物质都是中学化学的常见物质,它们的转化关系如右图所示(某些反应物或者反应条件没有标出).