题目内容
17.以NA表示阿佛加德罗常数,下列说法中正确的是( )| A. | 78g过氧化钠中含2NA个O2- | |
| B. | 0.1molOH-含NA个电子 | |
| C. | 1.8g重水(D2O)中含NA个中子 | |
| D. | 标准状况下11.2L臭氧中含NA个氧原子 |
分析 A.过氧化钠中含有过氧根离子,不存在氧离子;
B.氢氧根离子中含有10个电子,0.1mol氢氧根离子含有1mol电子;
C.重水中含有10个中子,其摩尔质量为20g/mol;
D.臭氧分子中含有3个氧原子.
解答 解:A.78g过氧化钠的物质的量为1mol,1mol过氧化钠中含有1mol过氧根离子,过氧化钠中不存在O2-,故A错误;
B.0.1molOH-含电子的物质的量为:0.1mol×10=1mol,含有NA个电子,故B正确;
C.1.8g重水(D2O)的物质的量为:$\frac{1.8g}{20g/mol}$=0.09mol,0.09mol该重水分子中含有中子的物质的量为:0.09mol×10=0.9mol,含有中子数目为0.9NA个,故C错误;
D.标准状况下11.2L臭氧的物质的量为0.5mol,0.5mol臭氧分子中含有1.5molO原子,含1.5NA个氧原子,故D错误;
故选B.
点评 本题考查阿伏加德罗常数的有关计算和判断,题目难度中等,注意掌握好以物质的量为中心的各化学量与阿伏加德罗常数的关系,准确弄清分子、原子、原子核内质子中子及核外电子的构成关系.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
7.将少量金属钠分别投入下列物质中,有气体放出,且溶液质量减轻的是( )
| A. | H2SO4 | B. | CuSO4 | C. | KNO3 | D. | KOH |
8.下列说法错误的是( )
| A. | 酸雨形成的主要原因是大量石油、煤等矿物燃料的燃烧 | |
| B. | 反应物的总能量高于生成物的总能量时,反应放热 | |
| C. | 原电池是化学能转变为电能的一种装置 | |
| D. | 在铜、锌和稀硫酸构成的原电池中,铜是负极 |
5.下列物质分类正确的是( )
| A. | Na2O2、Fe3O4、CuO均为碱性氧化物 | B. | 盐酸、水玻璃、氨水均为混合物 | ||
| C. | 烧碱、冰醋酸、四氯化碳均为电解质 | D. | 稀豆浆、硅酸、氯化铁溶液均为胶体 |
12.酸雨的形成主要原因是( )
| A. | 森林乱砍乱伐 | B. | 工业上大量使用含硫燃料 | ||
| C. | 大气中二氧化碳含量增多 | D. | 汽车排放出大量尾气 |
9.石墨和金刚石都是碳的单质,金刚石在一定条件下可以转化为石墨.已知12g金刚石完全转化为石墨时,要放收a kJ的能量.下列说法中正确的是( )
①石墨不如金刚石稳定
②金刚石不如石墨稳定
③等质量的石墨和金刚石完全燃烧,金刚石放出的能量多
④等质量的石墨和金刚石完全燃烧,石墨放出的能量多
⑤石墨能量低 ⑥金刚石能量高.
①石墨不如金刚石稳定
②金刚石不如石墨稳定
③等质量的石墨和金刚石完全燃烧,金刚石放出的能量多
④等质量的石墨和金刚石完全燃烧,石墨放出的能量多
⑤石墨能量低 ⑥金刚石能量高.
| A. | ①②⑥ | B. | ②③⑥ | C. | ①④⑥ | D. | ③④⑥ |
6.NA表示阿伏加德罗常数的值,下列说法正确的是( )
| A. | 30gSiO2晶体中含有NA个硅氧键 | |
| B. | 常温常压下,11.2LCl2含有的分子数目少于0.5NA | |
| C. | 25℃时,pH=12的NaOH溶液含有的OH-数目为0.01NA | |
| D. | 50mL18.4mol/L浓硫酸与足量铜微热,生成SO2分子的数目为0.46NA |
7.用如图所示装置和相应试剂能达到实验目的是( )
| 选项 | 实验目的 | 试剂a | 试剂b | 试剂c | 装置 |
| A | 验证非金属性:S>C>Si | 稀硫酸 | Na2CO3 | Na2SiO3溶液 | 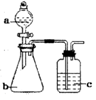 |
| B | 制备纯净的氯气 | 浓盐酸 | MnO2 | 饱和食盐水 | |
| C | 检验溶液X 中含有CO32- | 盐酸 | 溶液X | 澄清石灰水 | |
| D | 除去Na2SO3 中的Na2SO4 | 氯水 | 混合物 | NaOH 溶液 |
| A. | A | B. | B | C. | C | D. | D |
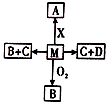 已知M、A、B、C、D、X六种物质都是中学化学的常见物质,它们的转化关系如右图所示(某些反应物或者反应条件没有标出).
已知M、A、B、C、D、X六种物质都是中学化学的常见物质,它们的转化关系如右图所示(某些反应物或者反应条件没有标出).