题目内容
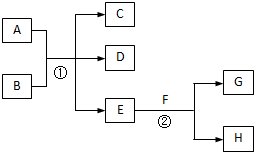
如图是部分常见元素的单质及其化合物的转化关系图(有关反应的条件及生成的部分产物已略去).

已知:E为红棕色固体,K为浅绿色溶液;反应①、②都是化工生产中的重要反应;B、C、D、H是单质;B、C、D、F、G、H常温下是气态; F、P 和H的水溶液均具有漂白作用,且F是形成酸雨的主要物质之一;N是一种常见的氮肥;化合物G分子构型为三角锥形,化合物M由两种元素组成,分子内共有58个电子.
(1)F的化学式 ;G的水溶液中,最多的阳离子是 .
(2)写出K与H反应的离子方程式: ;G与H反应的化学方程式: .
(3)在实验室中,向饱和H水溶液中加入CaCO3粉末,充分反应后过滤,可制得浓度较大的P的水溶液.用化学平衡移动的原理加以解释 .

已知:E为红棕色固体,K为浅绿色溶液;反应①、②都是化工生产中的重要反应;B、C、D、H是单质;B、C、D、F、G、H常温下是气态; F、P 和H的水溶液均具有漂白作用,且F是形成酸雨的主要物质之一;N是一种常见的氮肥;化合物G分子构型为三角锥形,化合物M由两种元素组成,分子内共有58个电子.
(1)F的化学式
(2)写出K与H反应的离子方程式:
(3)在实验室中,向饱和H水溶液中加入CaCO3粉末,充分反应后过滤,可制得浓度较大的P的水溶液.用化学平衡移动的原理加以解释
考点:无机物的推断
专题:推断题
分析:E为红棕色固体,可知E为Fe2O3,与盐酸反应生成J是FeCl3,K为浅绿色溶液,应为FeCl2,氯化亚铁与单质H反应得到氯化铁,故H是氯气,F与氯化铁反应得到氯化亚铁,F具有还原性,F是形成酸雨的主要物质之一,则F为SO2,反应①是化工生产中的重要反应,反应得到E与F,应是硫化亚铁与氧气反应生成氧化铁与二氧化硫,可推知A为FeS.N是一种常见的氮肥,化合物G分子构型为三角锥形,G与二氧化硫在溶液中反应得到L、L与盐酸反应得到N与二氧化硫,可推知G具有碱性,由转化关系可知G中含有N元素,故G是NH3,L为亚硫酸铵或亚硫酸氢铵,则N是NH4Cl,单质C与D反应得到G,C、D分别为氮气、氢气中的一种,化合物M由两种元素组成,分子内共有58个电子,由氯气与氨气反应得到,M与水反应得到P 和G,且P的水溶液均具有漂白作用,则M是NCl3,P为HClO,据此解答.
解答:
解:E为红棕色固体,可知E为Fe2O3,与盐酸反应生成J是FeCl3,K为浅绿色溶液,应为FeCl2,氯化亚铁与单质H反应得到氯化铁,故H是氯气,F与氯化铁反应得到氯化亚铁,F具有还原性,F是形成酸雨的主要物质之一,则F为SO2,反应①是化工生产中的重要反应,反应得到E与F,应是硫化亚铁与氧气反应生成氧化铁与二氧化硫,可推知A为FeS.N是一种常见的氮肥,化合物G分子构型为三角锥形,G与二氧化硫在溶液中反应得到L、L与盐酸反应得到N与二氧化硫,可推知G具有碱性,由转化关系可知G中含有N元素,故G是NH3,L为亚硫酸铵或亚硫酸氢铵,则N是NH4Cl,单质C与D反应得到G,C、D分别为氮气、氢气中的一种,化合物M由两种元素组成,分子内共有58个电子,由氯气与氨气反应得到,M与水反应得到P 和G,且P的水溶液均具有漂白作用,则M是NCl3,P为HClO,
(1)F的化学式为:SO2,G是NH3,其水溶液中氨气与水反应生成一水合氨,一水合氨电离出铵根离子与氢氧根离子,溶液呈碱性,溶液中最多阳离子为NH4+,
故答案为:SO2;NH4+;
(2)K为FeCl2,H是氯气,二者之间的反应为:2Fe2++Cl2=2Fe3++2Cl-,
G为氨气,H是氯气,二者之间的反应为:4NH3+3Cl2=NCl3+3NH4Cl,
故答案为:2Fe2++Cl2=2Fe3++2Cl-;4NH3+3Cl2=NCl3+3NH4Cl;
(3)在饱和氯气的水溶液中存在平衡:Cl2+H2O?H++Cl-+HClO,加入的碳酸钙,CaCO3粉末与H+反应,溶液中H+浓度减小,平衡正向移动,
故答案为:饱和氯气水溶液中存在平衡:Cl2+H2O H++Cl-+HClO,加入的CaCO3粉末与H+反应,平衡正向移动,HClO浓度增大.
H++Cl-+HClO,加入的CaCO3粉末与H+反应,平衡正向移动,HClO浓度增大.
(1)F的化学式为:SO2,G是NH3,其水溶液中氨气与水反应生成一水合氨,一水合氨电离出铵根离子与氢氧根离子,溶液呈碱性,溶液中最多阳离子为NH4+,
故答案为:SO2;NH4+;
(2)K为FeCl2,H是氯气,二者之间的反应为:2Fe2++Cl2=2Fe3++2Cl-,
G为氨气,H是氯气,二者之间的反应为:4NH3+3Cl2=NCl3+3NH4Cl,
故答案为:2Fe2++Cl2=2Fe3++2Cl-;4NH3+3Cl2=NCl3+3NH4Cl;
(3)在饱和氯气的水溶液中存在平衡:Cl2+H2O?H++Cl-+HClO,加入的碳酸钙,CaCO3粉末与H+反应,溶液中H+浓度减小,平衡正向移动,
故答案为:饱和氯气水溶液中存在平衡:Cl2+H2O
 H++Cl-+HClO,加入的CaCO3粉末与H+反应,平衡正向移动,HClO浓度增大.
H++Cl-+HClO,加入的CaCO3粉末与H+反应,平衡正向移动,HClO浓度增大.
点评:本题考查无机物推断,涉及转化关系较多,综合考查学生对元素化合物知识的整合能力,物质的盐酸、性质等时推断突破口,注意根据题目提供想信息进行推断,难度较大.

练习册系列答案
 黄冈创优卷系列答案
黄冈创优卷系列答案
相关题目
下列说法正确的是( )
| A、发生化学反应时失去电子越多的金属原子,还原能力越强 |
| B、金属阳离子被还原后,不一定得到该元素的单质 |
| C、核外电子总数相同的粒子,一定是同种元素的原子 |
| D、只能与酸反应的氧化物,一定是碱性氧化物 |
下列物质中,既含有离子键,又含有极性共价键的是( )
| A、NaCl |
| B、NH4NO3 |
| C、Fe2O3 |
| D、Na2O2 |
 在下列各变化中,E为无色无味的液体(常温下),F为淡黄色粉末,G为常见的无色气体(反应条件均已省略).
在下列各变化中,E为无色无味的液体(常温下),F为淡黄色粉末,G为常见的无色气体(反应条件均已省略).