题目内容
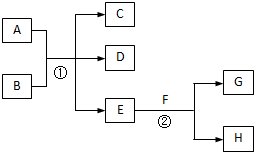 在下列各变化中,E为无色无味的液体(常温下),F为淡黄色粉末,G为常见的无色气体(反应条件均已省略).
在下列各变化中,E为无色无味的液体(常温下),F为淡黄色粉末,G为常见的无色气体(反应条件均已省略).回答下列问题:
(1)写出反应②的化学方程式
(2)若反应①在加热条件下进行,单质A和化合物B按物质的量之比为1:2发生反应,且C、D是两种均能使澄清的石灰水变浑浊的无色气体,则反应①的化学方程式是
(3)若反应①在溶液中进行,A是一元强碱,B是一种酸式盐,D是一种使湿润红色石蕊试纸变蓝的气体,且B遇盐酸能生成使品红溶液褪色的气体.在加热条件下,当A过量时,反应①的离子方程式是
考点:无机物的推断
专题:推断题
分析:E为无色无味的液体(常温下),F为淡黄色粉末,二者反应生成G为常见的无色气体,则E为H2O,F为Na2O2,G为O2,H为NaOH,
(1)过氧化钠与水反应生成NaOH与氧气,根据O元素化合价变化计算注意电子物质的量;
(2)若反应①在加热条件下进行,单质A和化合物B按物质的量之比为1:2发生反应,且C、D是两种均能使澄清的石灰水变浑浊的无色气体,应碳与浓硫酸反应,可推知A为碳,B为硫酸,C、D为二氧化碳、二氧化硫;
(3)若反应①在溶液中进行,A是一种强碱,B是一种酸式盐,D是一种使湿润红色石蕊试纸变蓝的气体,则D为氨气,B遇盐酸能生成使品红溶液褪色的气体,该气体为二氧化硫,则B为NH4HSO3,加热条件下与过量的强碱反应,生成亚硫酸盐、氨气与水.
(1)过氧化钠与水反应生成NaOH与氧气,根据O元素化合价变化计算注意电子物质的量;
(2)若反应①在加热条件下进行,单质A和化合物B按物质的量之比为1:2发生反应,且C、D是两种均能使澄清的石灰水变浑浊的无色气体,应碳与浓硫酸反应,可推知A为碳,B为硫酸,C、D为二氧化碳、二氧化硫;
(3)若反应①在溶液中进行,A是一种强碱,B是一种酸式盐,D是一种使湿润红色石蕊试纸变蓝的气体,则D为氨气,B遇盐酸能生成使品红溶液褪色的气体,该气体为二氧化硫,则B为NH4HSO3,加热条件下与过量的强碱反应,生成亚硫酸盐、氨气与水.
解答:
解:E为无色无味的液体(常温下),F为淡黄色粉末,二者反应生成G为常见的无色气体,则E为H2O,F为Na2O2,G为O2,H为NaOH,
(1)反应的方程式为2Na2O2+2H2O=4NaOH+O2↑,生成氧气的物质的量=
=0.1mol,反应其还原剂的过氧化钠生成氧气,故电子物质的量=0.1mol×2×[0-(-1)]=0.2mol,
故答案为:2Na2O2+2H2O═4NaOH+O2↑;0.2;
(2)若反应①在加热条件下进行,单质A和化合物B按物质的量之比为1:2发生反应,且C、D是两种均能使澄清的石灰水变浑浊的无色气体,应碳与浓硫酸反应,可推知A为碳,B为硫酸,C、D为二氧化碳、二氧化硫,反应①的化学方程式是:C+2H2SO4(浓)
CO2↑+2SO2↑+2H2O,
故答案为:C+2H2SO4(浓)
CO2↑+2SO2↑+2H2O;
(3)若反应①在溶液中进行,A是一种强碱,B是一种酸式盐,D是一种使湿润红色石蕊试纸变蓝的气体,则D为氨气,B遇盐酸能生成使品红溶液褪色的气体,该气体为二氧化硫,则B为NH4HSO3,加热条件下与过量的强碱反应,生成亚硫酸盐、氨气与水,反应①的离子方程式是NH4++HSO3-+2OH-
NH3↑+SO32-+2H2O,
故答案为:NH4++HSO3-+2OH-
NH3↑+SO32-+2H2O.
(1)反应的方程式为2Na2O2+2H2O=4NaOH+O2↑,生成氧气的物质的量=
| 2.24L |
| 22.4L/mol |
故答案为:2Na2O2+2H2O═4NaOH+O2↑;0.2;
(2)若反应①在加热条件下进行,单质A和化合物B按物质的量之比为1:2发生反应,且C、D是两种均能使澄清的石灰水变浑浊的无色气体,应碳与浓硫酸反应,可推知A为碳,B为硫酸,C、D为二氧化碳、二氧化硫,反应①的化学方程式是:C+2H2SO4(浓)
| ||
故答案为:C+2H2SO4(浓)
| ||
(3)若反应①在溶液中进行,A是一种强碱,B是一种酸式盐,D是一种使湿润红色石蕊试纸变蓝的气体,则D为氨气,B遇盐酸能生成使品红溶液褪色的气体,该气体为二氧化硫,则B为NH4HSO3,加热条件下与过量的强碱反应,生成亚硫酸盐、氨气与水,反应①的离子方程式是NH4++HSO3-+2OH-
| ||
故答案为:NH4++HSO3-+2OH-
| ||
点评:本题考查无机物推断,属于开放性题目,需要学生熟练掌握元素化合物性质,注意掌握中学常见反应条件、反应物量不同而产物的不同的反应.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
将0.5mol Na投入过量的水(m1g)中,得到a g溶液;将0.5mol Zn投入过量的盐酸(m2g)中,得到bg溶液,若m1═m2,则a.b的质量关系是( )
| A、a>b | B、a<b |
| C、a=b | D、不能确定 |
下列数字代表各元素的原子序数,则各组中相应的元素能形成XY2型共价化合物的是( )
| A、3和8 | B、1和16 |
| C、12和17 | D、6和16 |