题目内容
浓硫酸是一种强氧化性酸,在一定条件下能将多种金属、非金属单质氧化.请回答下列问题:
(1)写出浓硫酸与木炭粉在加热条件下反应的化学方程式: .
(2)试用如图1中所列各装置设计一个实验,验证上述反应所产生的各种产物,这种装置的连接顺序是(填编号) → → → .
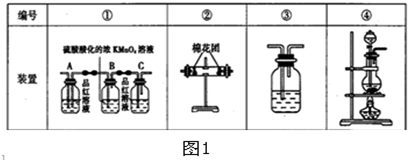
(3)实验时可观察到装置①中A瓶的溶液褪色,C瓶的溶液不褪色,B瓶中反应的离子方程式是 ;
C瓶溶液的作用是 .
(4)装置②中所加固体药品是 ,
(5)装置③中所盛溶液是 .
(6)铁在冷的浓硫酸中能发生钝化.某兴趣小组的同学发现将铁与一定量的浓硫酸加热时,观察到铁完全溶解得到溶液A,并产生大量气体B.
【提出猜想】
Ⅰ.所得溶液中的金属离子可能含有Fe2+和Fe3+中的一种或两种.
Ⅱ.所得气体B点可能组成是 .
【实验探究】实验室提供下列试剂和如图2的装置:
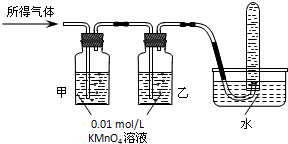
0.01mol/L酸性KMnO4溶液、0.1mol/L KSCN溶液、3%H2O2 溶液、淀粉溶液、蒸馏水.在配置0.01mol/L酸性KMnO4溶液过程中,需要用到的玻璃仪器是烧杯、玻璃棒、100mL容量瓶和 (填仪器名称).请你完成以下探究实验.
(1)写出浓硫酸与木炭粉在加热条件下反应的化学方程式:
(2)试用如图1中所列各装置设计一个实验,验证上述反应所产生的各种产物,这种装置的连接顺序是(填编号)

(3)实验时可观察到装置①中A瓶的溶液褪色,C瓶的溶液不褪色,B瓶中反应的离子方程式是
C瓶溶液的作用是
(4)装置②中所加固体药品是
(5)装置③中所盛溶液是
(6)铁在冷的浓硫酸中能发生钝化.某兴趣小组的同学发现将铁与一定量的浓硫酸加热时,观察到铁完全溶解得到溶液A,并产生大量气体B.
【提出猜想】
Ⅰ.所得溶液中的金属离子可能含有Fe2+和Fe3+中的一种或两种.
Ⅱ.所得气体B点可能组成是
【实验探究】实验室提供下列试剂和如图2的装置:

0.01mol/L酸性KMnO4溶液、0.1mol/L KSCN溶液、3%H2O2 溶液、淀粉溶液、蒸馏水.在配置0.01mol/L酸性KMnO4溶液过程中,需要用到的玻璃仪器是烧杯、玻璃棒、100mL容量瓶和
| 实验操作 | 预期现象 | 结论 | |
| 验证猜想Ⅰ | 含有Fe2+和Fe3+ | ||
| 验证猜想Ⅱ | 将所得气体通入如图2所示装置 | 含有两种气体 |
考点:性质实验方案的设计,浓硫酸的性质实验
专题:实验设计题
分析:(1)加热条件下,浓硫酸和碳反应生成二氧化碳、二氧化硫和水;
(2)根据气体的制取→检验水蒸气→检验二氧化硫→吸收二氧化硫→检验二氧化硫→检验二氧化碳的实验顺序排列;
(3)二氧化硫能被酸性高锰酸钾溶液氧化生成硫酸根离子,高锰酸根离子被还原生成锰离子;品红溶液能检验二氧化硫;
(4)无水硫酸铜检验水蒸气;
(5)二氧化碳能使澄清石灰水变浑浊;
(6)【提出猜想】铁和浓硫酸反应生成二氧化硫或氢气或二者都有;
【实验探究】根据仪器作用选取仪器;
验证猜想I.亚铁离子能使酸性高锰酸钾溶液褪色,铁离子能使KSCN溶液变红色;
验证猜想II.二氧化硫能使酸性高锰酸钾溶液褪色,氢气不溶于水,利用排水法能收集到氢气.
(2)根据气体的制取→检验水蒸气→检验二氧化硫→吸收二氧化硫→检验二氧化硫→检验二氧化碳的实验顺序排列;
(3)二氧化硫能被酸性高锰酸钾溶液氧化生成硫酸根离子,高锰酸根离子被还原生成锰离子;品红溶液能检验二氧化硫;
(4)无水硫酸铜检验水蒸气;
(5)二氧化碳能使澄清石灰水变浑浊;
(6)【提出猜想】铁和浓硫酸反应生成二氧化硫或氢气或二者都有;
【实验探究】根据仪器作用选取仪器;
验证猜想I.亚铁离子能使酸性高锰酸钾溶液褪色,铁离子能使KSCN溶液变红色;
验证猜想II.二氧化硫能使酸性高锰酸钾溶液褪色,氢气不溶于水,利用排水法能收集到氢气.
解答:
解:(1)加热条件下,浓硫酸和碳反应生成二氧化碳、二氧化硫和水,反应方程式为C+2H2SO4 (浓)
CO2↑+2SO2↑+2H2O,
故答案为:C+2H2SO4 (浓)
CO2↑+2SO2↑+2H2O;
(2)根据气体的制取→检验水蒸气→检验二氧化硫→吸收二氧化硫→检验二氧化硫→检验二氧化碳的实验顺序排列,所以其排列顺序是④→②→①→③,
故答案为:④;②;①;③;
(3)实验时可观察到装置①中A瓶的溶液褪色,C瓶的溶液不褪色,说明通过C瓶的气体不含二氧化硫,二氧化硫和高锰酸根离子反应方程式为2H2O+2MnO4-+5SO2=5SO42-+2Mn2++4H+,C瓶是检验二氧化硫是否除尽,防止干扰二氧化碳的检验,
故答案为:2H2O+2MnO4-+5SO2=5SO42-+2Mn2++4H+; 检验二氧化硫是否除尽;
(4)装置②是检验水蒸气,无水硫酸铜检验水蒸气,所以该装置中固体是无水硫酸铜,故答案为:无水硫酸铜;
(5)二氧化碳能使澄清石灰水变浑浊,所以该装置中药品是澄清石灰水,故答案为:澄清石灰水;
(6)【提出猜想】浓硫酸和铁反应生成二氧化硫,稀硫酸和铁反应生成氢气,所以所得气体中可能含有SO2、H2,故答案为:SO2、H2中的一种或两种;
【实验探究】用托盘天平称量高锰酸钾、用胶头滴管定容,所以还需要托盘天平和胶头滴管;
验证猜想I.亚铁离子能使酸性高锰酸钾溶液褪色,铁离子能使KSCN溶液变红色,其检验方法为:取少量液体倒入试管中,向试管中滴加KSCN溶液后,溶液变为血红色,说明含有铁离子,向溶液中滴加酸性高锰酸钾溶液,酸性高锰酸钾溶液褪色,说明含有亚铁离子,如果两种现象都有,则说明含有铁离子和亚铁离子;
验证猜想II.二氧化硫有还原性,能和强氧化性的物质发生氧化还原反应,如能使酸性高锰酸钾溶液褪色,氢气不能使酸性高锰酸钾溶液褪色,但氢气不易溶于水,所以如果甲中KMnO4溶液褪色,说明含有二氧化硫;乙中KMnO4溶液颜色不变,说明二氧化硫完全被吸收,如果试管中收集气体,只能是氢气,
故答案为:托盘天平、胶头滴管;
.
| ||
故答案为:C+2H2SO4 (浓)
| ||
(2)根据气体的制取→检验水蒸气→检验二氧化硫→吸收二氧化硫→检验二氧化硫→检验二氧化碳的实验顺序排列,所以其排列顺序是④→②→①→③,
故答案为:④;②;①;③;
(3)实验时可观察到装置①中A瓶的溶液褪色,C瓶的溶液不褪色,说明通过C瓶的气体不含二氧化硫,二氧化硫和高锰酸根离子反应方程式为2H2O+2MnO4-+5SO2=5SO42-+2Mn2++4H+,C瓶是检验二氧化硫是否除尽,防止干扰二氧化碳的检验,
故答案为:2H2O+2MnO4-+5SO2=5SO42-+2Mn2++4H+; 检验二氧化硫是否除尽;
(4)装置②是检验水蒸气,无水硫酸铜检验水蒸气,所以该装置中固体是无水硫酸铜,故答案为:无水硫酸铜;
(5)二氧化碳能使澄清石灰水变浑浊,所以该装置中药品是澄清石灰水,故答案为:澄清石灰水;
(6)【提出猜想】浓硫酸和铁反应生成二氧化硫,稀硫酸和铁反应生成氢气,所以所得气体中可能含有SO2、H2,故答案为:SO2、H2中的一种或两种;
【实验探究】用托盘天平称量高锰酸钾、用胶头滴管定容,所以还需要托盘天平和胶头滴管;
验证猜想I.亚铁离子能使酸性高锰酸钾溶液褪色,铁离子能使KSCN溶液变红色,其检验方法为:取少量液体倒入试管中,向试管中滴加KSCN溶液后,溶液变为血红色,说明含有铁离子,向溶液中滴加酸性高锰酸钾溶液,酸性高锰酸钾溶液褪色,说明含有亚铁离子,如果两种现象都有,则说明含有铁离子和亚铁离子;
验证猜想II.二氧化硫有还原性,能和强氧化性的物质发生氧化还原反应,如能使酸性高锰酸钾溶液褪色,氢气不能使酸性高锰酸钾溶液褪色,但氢气不易溶于水,所以如果甲中KMnO4溶液褪色,说明含有二氧化硫;乙中KMnO4溶液颜色不变,说明二氧化硫完全被吸收,如果试管中收集气体,只能是氢气,
故答案为:托盘天平、胶头滴管;
| 实验操作 | 预期现象 | 结论 | |
| 验证猜想Ⅰ | ①取少量0.01mol/L 酸性KMnO4溶液,滴入所得溶液 ②取少量KSCN溶液滴入所得溶液 | ①酸性高锰酸钾溶液褪色,说明含有亚铁离子; ②溶液变为血红色 | 含有Fe2+和Fe3+ |
| 验证猜想Ⅱ | 将所得气体通入如图2所示装置 | 甲中KMnO4溶液褪色,乙中KMnO4溶液颜色不变,试管中收集到气体 | 含有两种气体 |
点评:本题考查了性质实验方案设计,明确物质的性质是解本题关键,根据物质的性质确定可能发生的反应及反应现象,知道亚铁离子及铁离子的检验方法,难点是实验装置排序,根据实验目的及物质性质进行排序即可,题目难度中等.

练习册系列答案
 寒假学与练系列答案
寒假学与练系列答案
相关题目
下列物质不属于天然高分子化合物的是( )
| A、淀粉 | B、蚕丝 | C、油脂 | D、纤维素 |
在密闭容器中,一定量混合气体发生下列反应:aM(g)+bN(g)?cW(g),达一平衡后,测得M气体的浓度为0.5mol/L.当在恒温下,将密闭容器的体积扩大1倍,再达平衡时,测得M气体的浓度为0.3mol/L.则下列叙述正确的是( )
| A、W的体积分数降低 |
| B、平衡向右移动 |
| C、N的转化率提高 |
| D、反应速率增大 |
对有机物如图所示的分子叙述不正确的是( )


| A、能发生碱性水解1mol该有机物完全反应消耗8mol氢氧化钠 |
| B、常温下,与碳酸钠溶液反应放出二氧化碳 |
| C、该有机物含有三种官能团 |
| D、与稀硫酸共热反应后混合物中有三种有机物 |