题目内容
下列离子方程式书写正确的是( )
| A、铁与稀硫酸反应 Fe+2H+=Fe3++H2↑ | ||
| B、Na2O2与H2O反应制备O2:Na2O2+H2O=2Na++2OH-+O2↑ | ||
| C、氯气与水反应:Cl2+H2O=Cl-+2H++ClO- | ||
D、硅酸钠溶液中通入过量CO2:SiO32-+2CO2+2H2O=H2SiO3↓+2HCO
|
考点:离子方程式的书写
专题:离子反应专题
分析:A,反应生成硫酸亚铁和氢气;
B.电子不守恒;
C.HClO在离子反应中保留化学式;
D.反应生成硅酸和碳酸氢钠.
B.电子不守恒;
C.HClO在离子反应中保留化学式;
D.反应生成硅酸和碳酸氢钠.
解答:
解:A.铁与稀硫酸反应的离子反应为Fe+2H+=Fe2++H2↑,故A错误;
B.Na2O2与H2O反应制备O2的离子反应为2Na2O2+2H2O=4Na++4OH-+O2↑,故B错误;
C.氯气与水反应的离子反应为Cl2+H2O=Cl-+H++HClO,故C错误;
D.硅酸钠溶液中通入过量CO2的离子反应为SiO32-+2CO2+2H2O=H2SiO3↓+2HCO3-,故D正确;
故选D.
B.Na2O2与H2O反应制备O2的离子反应为2Na2O2+2H2O=4Na++4OH-+O2↑,故B错误;
C.氯气与水反应的离子反应为Cl2+H2O=Cl-+H++HClO,故C错误;
D.硅酸钠溶液中通入过量CO2的离子反应为SiO32-+2CO2+2H2O=H2SiO3↓+2HCO3-,故D正确;
故选D.
点评:本题考查离子方程式的书写,为高考常见题型,把握发生的化学反应为解答的关键,注意离子反应的书写方法及电子、电荷守恒,注意与量有关的离子反应为解答的难点,题目难度不大.

练习册系列答案
相关题目
pH值相等的盐酸甲和醋酸乙分别与锌反应,若最后锌已全部溶解且放出气体一样多.下列说法正确的是( )
| A、反应开始时的速率:甲>乙 |
| B、反应所需时间:甲<乙 |
| C、反应开始时,酸的物质的量浓度:甲<乙 |
| D、反应结速时pH值:甲<乙 |
物质的量相等的CO2和O2,它们一定具有相同的( )
| A、原子数 | B、质子数 |
| C、质量 | D、分子数 |
将含杂质的4.0克NaOH配成1000mL溶液,取20mL置于锥形瓶中与HCl质量分数为0.365%的盐酸反应,恰好消耗19.0克盐酸,则NaOH中含有杂质不可能是( )
| A、Na2SO4 |
| B、Na2CO3 |
| C、NaHCO3 |
| D、Ca(OH)2 |
下列离子方程式正确的是( )
A、向NH4HCO3溶液中,加入过量的氢氧化钠溶液,并加热 NH4++OH-
| ||||
| B、FeO加入硝酸中:FeO+2H+═Fe2++H2O | ||||
| C、向次氯酸钠溶液中通入少量SO2气体 2ClO-+SO2+H2O=2HClO+SO32- | ||||
D、实验室制氯气 MnO2+4H++2Cl-
|
下列叙述正确的是( )
| A、l mol N2的质量为28 g/mol |
| B、OH-的摩尔质量为17 g/mol |
| C、H2SO4的相对分子质量为98 g |
| D、l mol任何物质的质量等于该物质的相对分子质量 |
用NA表示阿伏伽德罗常数,下列说法中正确的是( )
| A、2.4g金属镁变成镁离子时失去的电子数为0.1NA |
| B、2g氢气中含有的原子数为2NA |
| C、标准状况下,22.4L水中含有的原子数目为1.5 NA |
| D、3.01×1023个氮分子中含有的原子数为2 NA |
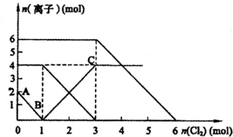 向FeI2、FeBr2的混合溶液中通入适量氯气,溶液中某些离子的物质的量变化如图所示.
向FeI2、FeBr2的混合溶液中通入适量氯气,溶液中某些离子的物质的量变化如图所示.