题目内容
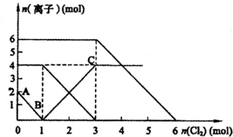 向FeI2、FeBr2的混合溶液中通入适量氯气,溶液中某些离子的物质的量变化如图所示.
向FeI2、FeBr2的混合溶液中通入适量氯气,溶液中某些离子的物质的量变化如图所示.已知:
2Fe2++Br2═2Fe3++2Br-
2Fe3++2I-═2Fe2++I2
(1)Fe2+、I-、Br-的还原性由强到弱排列顺序为
(2)当通入2mol Cl2时,溶液中已发生的离子反应可表示为:
(3)原混合溶液中FeBr2的物质的量为
(4)原溶液中:c (Fe2+):c (I-):c (Br-)=
考点:氧化性、还原性强弱的比较,离子方程式的书写,离子方程式的有关计算
专题:计算题,离子反应专题
分析:(1)氧化还原反应中:氧化剂的氧化性>氧化产物的氧化性,还原剂的还原性>还原产物的还原性;
(2)氧化剂先氧化还原性强的离子,再氧化还原性弱的离子;
(3)通入氯气后,碘离子先被氧化,其次是亚铁离子,最后是溴离子,在通入氯气的量为0~1mol的过程中,碘离子从最大量降到0,即得到碘离子的物质的量为2mol,通入氯气的量为1~3mol的过程中,亚铁离子从4mol降到0,三价铁的量逐渐增大,所以含有亚铁离子共4mol,在通入氯气的量为3~6mol的过程中溴离子从6ml降到0,所以溴离子的物质的量是6mol,即FeBr2的物质的量为3mol;
(4)依据(3)分析计算,碘离子的物质的量为2mol,亚铁离子是4mol,溴离子的物质的量是6mol,计算得到两种物质的量之比;
(2)氧化剂先氧化还原性强的离子,再氧化还原性弱的离子;
(3)通入氯气后,碘离子先被氧化,其次是亚铁离子,最后是溴离子,在通入氯气的量为0~1mol的过程中,碘离子从最大量降到0,即得到碘离子的物质的量为2mol,通入氯气的量为1~3mol的过程中,亚铁离子从4mol降到0,三价铁的量逐渐增大,所以含有亚铁离子共4mol,在通入氯气的量为3~6mol的过程中溴离子从6ml降到0,所以溴离子的物质的量是6mol,即FeBr2的物质的量为3mol;
(4)依据(3)分析计算,碘离子的物质的量为2mol,亚铁离子是4mol,溴离子的物质的量是6mol,计算得到两种物质的量之比;
解答:
解:(1)反应2Fe2++Br2=2Fe3++2Br-中,还原剂Fe2+的还原性强于还原产物Br-,所以还原性:Fe2+>Br-,反应2Fe3++2I-=2Fe2++I2中,还原剂I-的还原性强于还原产物Fe2+,所以还原性:I->Fe2+,所以还原性I->Fe2+>Br-;
故答案为:I->Fe2+>Br-;
(2)当通入2molCl2时,2mol的I-消耗氯气1mol,余下的1mol氯气再与2molFe2+反应,即溶液中发生的离子反应可表示为:2Fe2++2I-+2Cl2=2Fe3++I2+4Cl-;
故答案为:2Fe2++2I-+2Cl2=2Fe3++I2+4Cl-;
(3)通入氯气后,碘离子先被氧化,其次是亚铁离子,最后是溴离子,在通入氯气的量为0~1mol的过程中,碘离子从最大量降到0,即得到碘离子的物质的量为2mol,通入氯气的量为1~3mol的过程中,亚铁离子从4mol降到0,三价铁的量逐渐增大,所以含有亚铁离子共4mol,在通入氯气的量为3~6mol的过程中溴离子从6ml降到0,所以溴离子的物质的量是6mol,即FeBr2的物质的量为3mol;
故答案为:3mol;
(4)碘离子的物质的量为2mol,亚铁离子是4mol,溴离子的物质的量是6mol,n(Fe2+):n(I-):n(Br-)=2:1:3;
故答案为:2:1:3;
故答案为:I->Fe2+>Br-;
(2)当通入2molCl2时,2mol的I-消耗氯气1mol,余下的1mol氯气再与2molFe2+反应,即溶液中发生的离子反应可表示为:2Fe2++2I-+2Cl2=2Fe3++I2+4Cl-;
故答案为:2Fe2++2I-+2Cl2=2Fe3++I2+4Cl-;
(3)通入氯气后,碘离子先被氧化,其次是亚铁离子,最后是溴离子,在通入氯气的量为0~1mol的过程中,碘离子从最大量降到0,即得到碘离子的物质的量为2mol,通入氯气的量为1~3mol的过程中,亚铁离子从4mol降到0,三价铁的量逐渐增大,所以含有亚铁离子共4mol,在通入氯气的量为3~6mol的过程中溴离子从6ml降到0,所以溴离子的物质的量是6mol,即FeBr2的物质的量为3mol;
故答案为:3mol;
(4)碘离子的物质的量为2mol,亚铁离子是4mol,溴离子的物质的量是6mol,n(Fe2+):n(I-):n(Br-)=2:1:3;
故答案为:2:1:3;
点评:本题考查学生氧化还原反应中氧化性和还原性强弱的知识,综合性较强,难度较大.

练习册系列答案
相关题目
下列离子方程式书写正确的是( )
| A、铁与稀硫酸反应 Fe+2H+=Fe3++H2↑ | ||
| B、Na2O2与H2O反应制备O2:Na2O2+H2O=2Na++2OH-+O2↑ | ||
| C、氯气与水反应:Cl2+H2O=Cl-+2H++ClO- | ||
D、硅酸钠溶液中通入过量CO2:SiO32-+2CO2+2H2O=H2SiO3↓+2HCO
|
0.5mol H2的含义是( )
| A、含有0.5mol H |
| B、含有1mol H+ |
| C、含有H2分子数为 6.02×1023 |
| D、含有H原子数为 6.02×1023 |
对下列物质的叙述,不正确的是( )
| A、金属钠具有强还原性 |
| B、二氧化碳在一定条件下具有氧化性 |
| C、氧气通常具有氧化性而不具有还原性 |
| D、盐酸只具有氧化性 |
下列离子组合,能够大量共存的是( )
| A、酸性溶液中:Al3+、Fe3+、SO42-、SCN- |
| B、透明溶液中:MnO4-、K+、Na+、NO3- |
| C、加入铝粉后产生氢气的溶液中:Ba2+、K+、NO3-、Al3+ |
| D、强酸性溶液中:Na+、Fe2+、SO42-、NO3- |
两种金属混合物20.75克,投入到一定量的盐酸中,反应完全后得到11.2L(标准状况)的氢气,此金属混合物不可能是( )
| A、Mg和Al |
| B、Al和Fe |
| C、Fe和Zn |
| D、Mg和Cu |
设阿伏加德罗常数为6.02×1023mol-1.关于0.5mol H2O的叙述正确的是( )
| A、含有0.5 mol H2 |
| B、含有3.01×1023个水分子 |
| C、质量为9 g/mol |
| D、在标准状况下的体积为11.2L |