题目内容
12.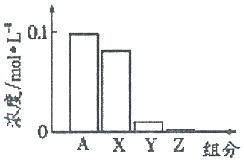 常温下,0.2moI•L-l的Na2CO3溶液与0.2moI•L-l的盐酸等体积混合后,所得溶液中部分微粒组分与浓度的关系如图所示,X、Y、Z均表示含碳微粒,下列说法正确的是( )
常温下,0.2moI•L-l的Na2CO3溶液与0.2moI•L-l的盐酸等体积混合后,所得溶液中部分微粒组分与浓度的关系如图所示,X、Y、Z均表示含碳微粒,下列说法正确的是( )| A. | A代表Na+浓度 | |
| B. | 该溶液中c(OH-)>c(Y) | |
| C. | 向该溶液中加水稀释,所有离子浓度均减小 | |
| D. | 该混合溶液中:c(X)+c(Y)+c(Z)═2c(Na+) |
分析 常温下,0.2moI•L-l的Na2CO3溶液与0.2moI•L-l的盐酸等体积混合后,反应后溶质为碳酸氢钠和氯化钠,HCO3-水解程度大于电离程度,溶液呈碱性,则反应后溶液中满足:c(Na+)=0.2mol/L>c(Cl-)=0.1mol/L>c(HCO3-)>c(OH-)>c(H2CO3)>c(H+)>c(CO32-),X、Y、Z均表示含碳微粒,结合图象可知A为Cl-、X为HCO3-、Y为H2CO3、Z为CO32-,据此进行解答.
解答 解:A.根据分析可知,A为Cl-,故A错误;
B.溶液中存在3个平衡,以水解为主,HCO3-+H2O?H2CO3+OH-,HCO3-?H++CO32-,H2O?H++OH-,Y为H2CO3,水还电出氢氧根,则溶液中c(OH-)>c(Y),故B正确;
C.向该溶液中加水稀释,碱性减弱,c(OH-)减小,温度不变,水的离子积不变,则c(H+)增大,故C错误;
D.X为HCO3-、Y为H2CO3、Z为CO32-,根据碳原子守恒则c(X)+c(Y)+c(Z)为:c(HCO3-)+c(H2CO3)+c(CO32-)=0.1mol/L,c(Na+)=0.2mol/L则c(X)+c(Y)+c(Z)=$\frac{1}{2}$c(Na+),故D错误;
故选B.
点评 本题考查了水解的综合应用,是高频考点,正确推断各粒子组成为解答关键,注意掌握离子浓度大小比较方法,试题有利于提高学生的分析能力及逻辑推理能力,题目难度中等.

练习册系列答案
相关题目
3.一定条件下,对于可逆反应X(g)+3Y(g)?2Z(g),若X、Y、Z的起始浓度分别为c1、c2、c3 (均不为零),平衡时 X、Y、Z 的浓度分别为 0.1mol/L、0.3mol/L、0.08mol/L,则下列判断正确的( )
| A. | c1:c2=3:1 | |
| B. | 平衡时.Y和Z的生成速率之比为2:3 | |
| C. | X、Y的转化率不相等 | |
| D. | c1 的取值范围为 0 mol/L<c1<0.14 mol/L |
20.X、Y、Z、R、W是原子序数依次增大的五种短周期元素.Y和R同主族,可组成共价化合物RY2,Y和Z最外层电子数之和与W的最外层电子数相同,25℃时,0.1mol/LX和W形成化合物的水溶液pH=1.下列说法正确的是( )
| A. | Z与Y、Z与W形成的化合物的化学键完全相同 | |
| B. | X与Y组成的简单氢化物的沸点高于X与R组成的简单氢化物的沸点,是因为非金属性Y>R | |
| C. | 简单离子的半径:Z>R>W>Y | |
| D. | Y、Z、W三种元素组成的化合物的水溶液可能显碱性 |
7.W、X、Y、Z均是短周期元素,X、Y、Z处于同一周期,W、X、Z的简单离子具有相同的电子层结构,W的最高氧化物的水化物可与其最简单的气态氢化物反应生成易溶于水的盐,X的氧化物具有两性,Y的最高正价与最低负价的代数和为0,下列说法正确的是( )
| A. | 离子半径:W>Z>X | |
| B. | 单质熔点:W>Z | |
| C. | 最高正价:W>X>Y>Z | |
| D. | W、X、Z最高价氧化物对应的水化物相互之间能发生反应 |
17.硫铁矿焙烧后的烧渣含有Fe2O3、FcO、SiO2、Al2O3,用过量硫酸浸取,过滤,将滤液分别与下列指定物质反应,所得溶液中主要存在的一组离子正确的是( )
| A. | 过量 Cl2:Fe2+、H+、Al3+、Cl-、SO42- | |
| B. | 过量SO2:Fe2+、H+、Al3+、SO42- | |
| C. | 过量氨水:NH4+、AlO2-、SO42-、OH- | |
| D. | 过量 Na2O2:Na+、Fe3+、SO42-、OH- |
14.下列实验中,对应的现象以及结论都正确且两者具有因果关系的是( )
| 选项 | 实验 | 现象 | 结论 |
| A | 将等物质的量的SO2与Cl2混合后,通入品红溶液 | 品红褪色 | SO2、Cl2都能使品红褪色 |
| B | 将Fe2O3溶于足量氢碘酸溶液,然后滴入淀粉溶液 | 溶液变蓝 | 氧化性:Fe3+>I2 |
| C | 注射器中吸入NO2,封堵针尖处,将注射器体积压缩为原来的一半 | 气体颜色比起始时浅 | 加压后,NO2转变为无色的N2O4 |
| D | 饱和BaSO4悬浊液中加入饱和Na2CO3溶液,振荡,然后过滤、洗涤,向所得固体中加入盐酸 | 沉淀部分溶解且有气体产生 | Ksp(BaSO4)> Ksp(BaCO3) |
| A. | A | B. | B | C. | C | D. | D |
 A、B、C、D、E、F是分属三个短周期的主族元素,且原子序数依次增大.A、D同主族,B的氢化物水溶液呈碱性,C、E同主族,形成的化合物EC2是形成酸雨的主要物质之一.请化学用语回答下列问题:
A、B、C、D、E、F是分属三个短周期的主族元素,且原子序数依次增大.A、D同主族,B的氢化物水溶液呈碱性,C、E同主族,形成的化合物EC2是形成酸雨的主要物质之一.请化学用语回答下列问题: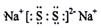 ,写出在空气中长期放置生成H的化学反应方程式为:4Na2S+O2+2H2O=4NaOH+2Na2S2.H的溶液与稀硫酸反应产生的现象为溶液由黄色变为无色,产生浅黄色沉淀和气体产生.
,写出在空气中长期放置生成H的化学反应方程式为:4Na2S+O2+2H2O=4NaOH+2Na2S2.H的溶液与稀硫酸反应产生的现象为溶液由黄色变为无色,产生浅黄色沉淀和气体产生.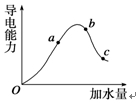 一定温度下,冰醋酸在加水稀释过程中溶液导电能力的变化曲线如图所示,请回答下列问题:
一定温度下,冰醋酸在加水稀释过程中溶液导电能力的变化曲线如图所示,请回答下列问题: