题目内容
11.对下列实验过程的评价,正确的是( )| A. | 验证烧碱溶液中是否含有Cl-,先加稀硝酸除去OH-,再加入AgNO3溶液,有白色沉淀,证明含Cl- | |
| B. | 某溶液中滴加BaCl2溶液,生成白色沉淀,证明一定含有SO42- | |
| C. | 某无色溶液滴入紫色石蕊试液显红色,该溶液一定显碱性 | |
| D. | 某固体中加入稀盐酸,产生了无色气体,证明该固体中一定含有碳酸盐或碳酸氢盐 |
分析 A.氯离子用硝酸酸化的硝酸银溶液检验,如果产生白色不溶于稀硝酸的沉淀就说明含有氯离子;
B.能和氯化钡溶液生成白色沉淀的有硫酸根离子、银离子、亚硫酸根离子等;
C.能使紫色石蕊变红色的溶液呈酸性;
D.亚硫酸盐、亚硫酸氢盐、硫化钠等物质也都能和稀盐酸反应生成无色气体.
解答 解:A.氯离子用硝酸酸化的硝酸银溶液检验,如果产生白色不溶于稀硝酸的沉淀就说明含有氯离子,所以验证烧碱溶液中是否含有Cl-,先加稀硝酸除去OH-,防止氢氧根离子和硝酸银反应而干扰实验,然后再加入AgNO3溶液,有白色沉淀,证明含Cl-,否则不含氯离子,故A正确;
B.能和氯化钡溶液生成白色沉淀的有硫酸根离子、银离子、亚硫酸根离子等,所以该实验现象不能证明原溶液中含有硫酸根离子,应该用盐酸酸化的氯化钡溶液检验硫酸根离子,故B错误;
C.能使紫色石蕊变红色的溶液呈酸性,所以该溶液呈酸性,故C错误;
D.亚硫酸盐、亚硫酸氢盐、硫化钠等物质也都能和稀盐酸反应生成无色气体,所以该实验现象不能说明溶液中含有碳酸盐或碳酸氢盐,故D错误;
故选A.
点评 本题考查化学实验方案评价,为高频考点,涉及物质检验、离子检验等知识点,明确实验原理及物质性质是解本题关键,注意离子或物质检验时要排除其它物质或离子的干扰,知道硫酸根离子、氯离子、铁离子、亚铁离子等离子的检验方法,易错选项是D.

练习册系列答案
相关题目
19.下列属于混合物的是( )
| A. | 硅酸钠 | B. | 铜 | C. | 氢氧化铁胶体 | D. | 二氧化碳 |
6.设NA为阿伏加德罗常数的数值,下列说法正确的是( )
| A. | 25℃时,1LpH=2的HCl溶液中,由水电离出的H+的数目0.01NA | |
| B. | 标准状况下,2.24L的CCl4中含有的氯原子数为0.4NA | |
| C. | 常温下,1molCO2中含有的共用电子对数目为2NA | |
| D. | 标准状况下,2.24L Cl2与水充分反应,转移的电子数小于0.1NA |
3.下列叙述正确的是( )
| A. | FeC13和MnO2均可加快H2O2分解,同等条件下二者对H2O2分解速率的改变相同 | |
| B. | 其他条件不变,向稀H2SO4与过量Zn的混合物中加少量铜片,既能增大H2生成速率,又能减小生成H2的物质的量 | |
| C. | 其他条件不变,加热或加压都能使H2(g)+I2(g)?2HI(g)的v正和v逆同时增大 | |
| D. | v=$\frac{△c}{△t}$是化学上表示化学反应速率的唯一方法 |
17.恒温下,在容积为2L的甲、乙两个恒容密闭容器中分别充入H2和I2发生可逆反应:
I2(g)+H2(g)═2HI(g)△H=-QkJ•mol-1,实验时有关数据如表:
下列判断正确的是( )
I2(g)+H2(g)═2HI(g)△H=-QkJ•mol-1,实验时有关数据如表:
| 容器编号 | 起始物质的量/mol | 4分钟后平衡时的物质的量/mol | 平衡时放出的热量/kJ | |
| I2 | H2 | HI | ||
| 甲 | 0.01 | 0.01 | 0.004 | Q1 |
| 乙 | 0.02 | 0.02 | a | Q2 |
| A. | 甲容器中,4分钟内氢气的反应速率为5.0×10-4 mol•L-1•min-1 | |
| B. | 平衡时,放出的热量为:Q1=4.0×10-3Q kJ | |
| C. | 平衡后,a=8.0×10-3mol,故乙中HI的质量分数比甲中高 | |
| D. | 该温度下,该反应的平衡常数K=0.25 |
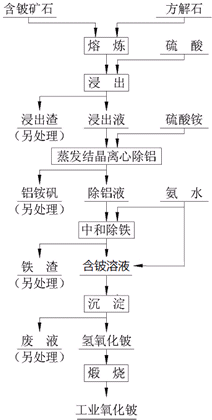 硫酸法是现代氧化铍或氢氧化铍生产中广泛应用的方法之一,其原理是利用预焙烧破坏铍矿物(绿柱石-3BeO•Al2O3•6SiO2及少量FeO等)的结构与晶型,再采用硫酸酸解含铍矿物,使铍、铝、铁等酸溶性金属进入溶液相,与硅等脉石矿物初步分离,然后将含铍溶液进行净化、除杂,最终得到合格的氧化铍( 或氢氧化铍) 产品,其工艺流程如图.
硫酸法是现代氧化铍或氢氧化铍生产中广泛应用的方法之一,其原理是利用预焙烧破坏铍矿物(绿柱石-3BeO•Al2O3•6SiO2及少量FeO等)的结构与晶型,再采用硫酸酸解含铍矿物,使铍、铝、铁等酸溶性金属进入溶液相,与硅等脉石矿物初步分离,然后将含铍溶液进行净化、除杂,最终得到合格的氧化铍( 或氢氧化铍) 产品,其工艺流程如图. 连二亚硫酸钠(Na2S2O4),又称保险粉,是印刷工业中重要的还原剂.某课题小组进行如下实验:
连二亚硫酸钠(Na2S2O4),又称保险粉,是印刷工业中重要的还原剂.某课题小组进行如下实验: