题目内容
2.除去下列物质中所含杂质(括号内为杂质),写出除去杂质的化学方程式.①Fe2O3(Al2O3)Al2O3+2NaOH═2NaAlO2+H2O
②NaHCO3溶液中(Na2CO3)Na2CO3+H2O+CO2=2NaHCO3.
分析 (1)Al2O3与NaOH溶液反应,而Fe2O3不能,则加足量NaOH溶解后过滤可除杂;
(2)碳酸钠溶液与二氧化碳、水反应生成碳酸氢钠,以此来解答.
解答 解:(1)Al2O3与NaOH溶液反应,而Fe2O3不能,则加足量NaOH溶解后过滤可除杂,则选择试剂为NaOH,发生的离子反应为Al2O3+2NaOH═2NaAlO2+H2O,
故答案为:Al2O3+2NaOH═2NaAlO2+H2O;
(2)碳酸钠溶液与二氧化碳、水反应生成碳酸氢钠,则除杂反应为Na2CO3+H2O+CO2=2NaHCO3,故答案为:Na2CO3+H2O+CO2=2NaHCO3.
点评 本题考查混合物分离提纯,为高频考点,把握物质的性质、发生的反应、混合物分离为解答的关键,侧重分析与应用能力的考查,注意元素化合物知识的应用,题目难度不大.

练习册系列答案
 第1卷单元月考期中期末系列答案
第1卷单元月考期中期末系列答案
相关题目
4.某无色透明的溶液,在pH=0和pH=14的条件下都能大量共存的是( )
| A. | Na+ K+ SO42- AlO2- | B. | Ca2+ Na+ SO42- Cl- | ||
| C. | Na+ K+ SO42- NO3- | D. | K+ Na+ MnO4- SO42- |
10.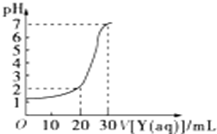 如图为常温下10mL一定物质的量浓度的盐酸X,用一定物质量浓度的NaOH溶液Y滴定的图示,据图推出NaOH溶液和盐酸的物质的量浓度正确的是( )
如图为常温下10mL一定物质的量浓度的盐酸X,用一定物质量浓度的NaOH溶液Y滴定的图示,据图推出NaOH溶液和盐酸的物质的量浓度正确的是( )
 如图为常温下10mL一定物质的量浓度的盐酸X,用一定物质量浓度的NaOH溶液Y滴定的图示,据图推出NaOH溶液和盐酸的物质的量浓度正确的是( )
如图为常温下10mL一定物质的量浓度的盐酸X,用一定物质量浓度的NaOH溶液Y滴定的图示,据图推出NaOH溶液和盐酸的物质的量浓度正确的是( )| A | B | C | D | |
| HCl(mol/L) | 0.12 | 0.04 | 0.09 | 0.12 |
| NaOH(mol/L) | 0.04 | 0.12 | 0.03 | 0.06 |
| A. | A | B. | B | C. | C | D. | D |
11.对下列实验过程的评价,正确的是( )
| A. | 验证烧碱溶液中是否含有Cl-,先加稀硝酸除去OH-,再加入AgNO3溶液,有白色沉淀,证明含Cl- | |
| B. | 某溶液中滴加BaCl2溶液,生成白色沉淀,证明一定含有SO42- | |
| C. | 某无色溶液滴入紫色石蕊试液显红色,该溶液一定显碱性 | |
| D. | 某固体中加入稀盐酸,产生了无色气体,证明该固体中一定含有碳酸盐或碳酸氢盐 |
9.一定条件下,可逆反应X(g)+3Y(g)?2Z(g),若X、Y、Z起始浓度分别为c1、c2、c3(单位mol/L),当达平衡时X、Y、Z的浓度分别为0.1mol/L,0.3mol/L,0.08mol/L,则下列判断不合理的是( )
| A. | c1:c2=1:3 | |
| B. | 当4v(X)正=v(Y)逆时,该反应还在向逆反应方向建立平衡 | |
| C. | X、Y的转化率不相等 | |
| D. | Y起始浓度c2可能为0.36mol/L |
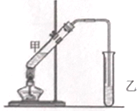 酒在储存过程中生成了有香味的乙酸乙酯,在实验室我们也可以用如下图所示的装置制取乙酸乙酯.回答下列问题:
酒在储存过程中生成了有香味的乙酸乙酯,在实验室我们也可以用如下图所示的装置制取乙酸乙酯.回答下列问题: 我国食盐有80%来自底下井盐和岩盐,用盐井水晒盐是制取食盐的常用方法.
我国食盐有80%来自底下井盐和岩盐,用盐井水晒盐是制取食盐的常用方法.