题目内容
17.恒温下,在容积为2L的甲、乙两个恒容密闭容器中分别充入H2和I2发生可逆反应:I2(g)+H2(g)═2HI(g)△H=-QkJ•mol-1,实验时有关数据如表:
| 容器编号 | 起始物质的量/mol | 4分钟后平衡时的物质的量/mol | 平衡时放出的热量/kJ | |
| I2 | H2 | HI | ||
| 甲 | 0.01 | 0.01 | 0.004 | Q1 |
| 乙 | 0.02 | 0.02 | a | Q2 |
| A. | 甲容器中,4分钟内氢气的反应速率为5.0×10-4 mol•L-1•min-1 | |
| B. | 平衡时,放出的热量为:Q1=4.0×10-3Q kJ | |
| C. | 平衡后,a=8.0×10-3mol,故乙中HI的质量分数比甲中高 | |
| D. | 该温度下,该反应的平衡常数K=0.25 |
分析 甲中平衡时HI的浓度为0.004mol,则:
H2(g)+I2(g)?2HI(g)△H=-14.9kJ/mol
开始(mol):0.01 0.01 0
变化(mol):0.002 0.002 0.004
平衡(mol):0.008 0.008 0.004
乙中I2、H2为甲的2倍,因反应前后气体的计量数之和相等,则增大压强平衡不一定,甲、乙平衡状态相同,以此解答该题.
解答 解:甲中平衡时HI的浓度为0.004mol,则:
H2(g)+I2(g)?2HI(g)△H=-14.9kJ/mol
开始(mol):0.01 0.01 0
变化(mol):0.002 0.002 0.004
平衡(mol):0.008 0.008 0.004
A.甲容器中,4分钟内氢气的反应速率为$\frac{\frac{0.002mol}{2L}}{4min}$=2.5.0×10-4 mol•L-1•min-1,故A错误;
B.平衡时,放出的热量为:Q1=0.002mol×QkJ•mol-1=2.0×10-3Q kJ,故B错误;
C.甲、乙平衡状态相同,则各物质的含量也相同,故C错误;
D.该温度下,该反应的平衡常数K=$\frac{(\frac{0.004}{2})^{2}}{\frac{0.008}{2}×\frac{0.008}{2}}$=0.25,故D正确.
故选D.
点评 本题考查等效平衡、化学平衡常数的计算等知识,为高频考点,侧重于学生的分析能力的考查,主要把握甲乙平衡状态的判断,难度中等,注意理解等效平衡规律.

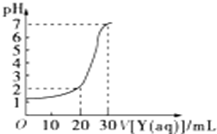 如图为常温下10mL一定物质的量浓度的盐酸X,用一定物质量浓度的NaOH溶液Y滴定的图示,据图推出NaOH溶液和盐酸的物质的量浓度正确的是( )
如图为常温下10mL一定物质的量浓度的盐酸X,用一定物质量浓度的NaOH溶液Y滴定的图示,据图推出NaOH溶液和盐酸的物质的量浓度正确的是( )| A | B | C | D | |
| HCl(mol/L) | 0.12 | 0.04 | 0.09 | 0.12 |
| NaOH(mol/L) | 0.04 | 0.12 | 0.03 | 0.06 |
| A. | A | B. | B | C. | C | D. | D |
| A. | 验证烧碱溶液中是否含有Cl-,先加稀硝酸除去OH-,再加入AgNO3溶液,有白色沉淀,证明含Cl- | |
| B. | 某溶液中滴加BaCl2溶液,生成白色沉淀,证明一定含有SO42- | |
| C. | 某无色溶液滴入紫色石蕊试液显红色,该溶液一定显碱性 | |
| D. | 某固体中加入稀盐酸,产生了无色气体,证明该固体中一定含有碳酸盐或碳酸氢盐 |
| 活性炭 | NO | N2 | X | |
| 初始 | 2.030 | 0.100 | 0 | 0 |
| T1 | 2.000 | 0.040 | 0.030 | 0.030 |
| T2 | 2.005 | 0.050 | 0.025 | 0.025 |
| A. | 气体X的化学式为CO2 | |
| B. | T1℃时的平衡常数K1=$\frac{9}{32}$ | |
| C. | 根据上述信息判断,T1>T2 | |
| D. | T1℃时,向平衡体系中继续加入活性炭,可提高NO的转化率 |
| 容器编号 | 起始时各物质物质的量/mol | 达平衡时体系能量的变化 | ||
| X2 | Y2 | XY3 | ||
| ① | 1 | 3 | 0 | 放热46.3 kJ |
| ② | 0.8 | 2.4 | 0.4 | Q(Q>0) |
| A. | 容器①中达到平衡时,Y2的转化率为50% | |
| B. | Q=27.78kJ | |
| C. | 容器①、②中反应的平衡常数相等,K=$\frac{16}{27}$ | |
| D. | 相同温度下;起始时向容器中充入1.0X2mol、3.0molY2和2molXY3;反应达到平衡前v(正)>v(逆) |
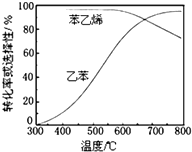 乙苯催化脱氢制苯乙烯反应:
乙苯催化脱氢制苯乙烯反应: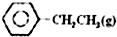 $\stackrel{催化剂}{?}$
$\stackrel{催化剂}{?}$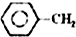 =CH2(g)+H2(g)
=CH2(g)+H2(g)(1)已知:
| 化学键 | C-H | C-C | C=C | H-H |
| 键能/kJ•molˉ1 | 412 | 348 | 612 | 436 |
(2)维持体系总压强p恒定,在温度T时,物质的量为n、体积为V的乙苯蒸汽发生催化脱氢反应.已知乙苯的平衡转化率为α,则在该温度下反应的平衡常数Kp=$\frac{n{α}^{2}}{(1-{α}^{2})V}$(用α等符号表示).
(3)工业上,通常在乙苯蒸气中掺混水蒸气(原料气中乙苯和水蒸气的物质的量之比为1:9),控制反应温度600℃,并保持体系总压为常压的条件下进行反应.在不同反应温度下,乙苯的平衡转化率和某催化剂作用下苯乙烯的选择性(指除了H2以外的产物中苯乙烯的物质的量分数)示意图如图:
①掺入水蒸气能提高乙苯的平衡转化率,解释说明该事实正反应为气体分子数增大的反应,保持压强不变,加入水蒸气,容器体积应增大,等效为降低压强,平衡向正反应方向移动.
②控制反应温度为600℃的理由是600℃时乙苯的转化率与苯乙烯的选择性均较高,温度过低,反应速率较慢,转化率较低,温度过高,选择性下降,高温下可能失催化剂失去活性,且消耗能量较大.
(4)某研究机构用CO2代替水蒸气开发了绿色化学合成工艺----乙苯-二氧化碳耦合催化脱氢制苯乙烯.保持常压和原料气比例不变,与掺水蒸汽工艺相比,在相同的生产效率下,可降低操作温度;该工艺中还能够发生反应:CO2+H2═CO+H2O,CO2+C═2CO.新工艺的特点有①②③④(填编号).
①CO2与H2反应,使乙苯脱氢反应的化学平衡右移
②不用高温水蒸气,可降低能量消耗
③有利于减少积炭
④有利用CO2资源利用.
| A. | c1:c2=1:3 | |
| B. | 当4v(X)正=v(Y)逆时,该反应还在向逆反应方向建立平衡 | |
| C. | X、Y的转化率不相等 | |
| D. | Y起始浓度c2可能为0.36mol/L |
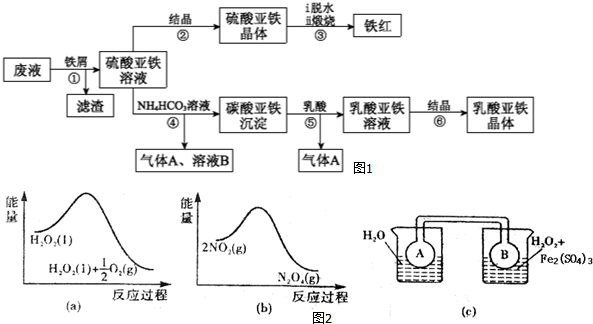
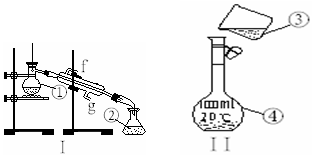 掌握仪器的名称、组装及使用方法是中学化学实验的基础,如图为两套实验装置.
掌握仪器的名称、组装及使用方法是中学化学实验的基础,如图为两套实验装置.