题目内容
15.一定条件下,反应:C(s)+CO2(g)?2CO(g)在2L恒容密闭容器中进行,反应进行20s时,CO的物质的量增加了0.40mol,则下列说法正确的是( )| A. | 该反应是一熵减反应 | |
| B. | 升高温度时,反应向逆方向进行 | |
| C. | 反应平衡时,v (CO2):v (CO)=1:2 | |
| D. | 充入N2使体系压强增大,能提高反应速率 |
分析 A.C(s)+CO2(g)?2CO(g)为气体体积增加的反应;
B.C(s)+CO2(g)?2CO(g)为吸热反应;
C.反应速率之比等于化学计量数之比;
D.在2L恒容密闭容器中进行,充入N2,c (CO2)、c (CO)均不变.
解答 解:A.C(s)+CO2(g)?2CO(g)为气体体积增加的反应,则该反应为熵增反应,故A错误;
B.C(s)+CO2(g)?2CO(g)为吸热反应,则升高温度,反应向正反应方向移动,故B错误;
C.反应速率之比等于化学计量数之比,则反应平衡时,v (CO2):v (CO)=1:2,故C正确;
D.在2L恒容密闭容器中进行,充入N2,c (CO2)、c (CO)均不变,则反应速率不变,故D错误;
故选C.
点评 本题考查化学平衡的影响因素,为高频考点,把握反应的特点、温度和浓度对反应速率的影响为解答的关键,侧重分析与应用能力的考查,注意选项D为易错点,题目难度不大.

练习册系列答案
 桃李文化快乐暑假武汉出版社系列答案
桃李文化快乐暑假武汉出版社系列答案 优秀生快乐假期每一天全新寒假作业本系列答案
优秀生快乐假期每一天全新寒假作业本系列答案 暑假接力赛新疆青少年出版社系列答案
暑假接力赛新疆青少年出版社系列答案
相关题目
4.原子序数依次增大的X、Y、Z、W四种短周期元素,X、W原子的最外层电子数与其电子层数相等:X能分别与Y、Z能形成10电子的化合物,常温下Y与X形成的是一种刺激性气味的气体,X与Z形成化合物是一种液体.下列说法正确的是( )
| A. | Y、Z分别与X形成的氢化物含有一种特殊的化学键即氢键 | |
| B. | W的氯化物水溶液中通入过量YX3气体会出现先沉淀后沉淀溶解的现象 | |
| C. | 由X、Y、Z组成盐的水溶液呈酸性,则溶液中该盐阳离子浓度小于酸根离子浓度 | |
| D. | 已知YX3形成的水溶液能导电,说明YX3是一种电解质 |
5.同温同压下,等质量的SO2和CO2比较,下列叙述正确的是( )
| A. | 密度比是16:11 | B. | 密度比是11:16 | C. | 体积比是1:1 | D. | 体积比是16:11 |
20.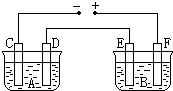 如图所示,A池用石墨电极电解氢氧化钠溶液,B池精炼粗铜.一段时间后停止通电,A池D极产生的气体在标准状况下为2.24L,则B池中E极质量的变化是( )
如图所示,A池用石墨电极电解氢氧化钠溶液,B池精炼粗铜.一段时间后停止通电,A池D极产生的气体在标准状况下为2.24L,则B池中E极质量的变化是( )
 如图所示,A池用石墨电极电解氢氧化钠溶液,B池精炼粗铜.一段时间后停止通电,A池D极产生的气体在标准状况下为2.24L,则B池中E极质量的变化是( )
如图所示,A池用石墨电极电解氢氧化钠溶液,B池精炼粗铜.一段时间后停止通电,A池D极产生的气体在标准状况下为2.24L,则B池中E极质量的变化是( )| A. | 质量增加6.4 g | B. | 质量增加12.8 g | C. | 质量减少6.4 g | D. | 质量减少12.8 g |
4.利用海水提取溴和镁的过程如下,下列说法不正确的是( )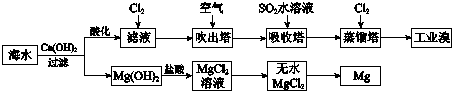

| A. | 工业上常利用电解熔融MgCl2冶炼金属镁 | |
| B. | 工业上可用NaBr溶液除去溴中含有的少量Cl2 | |
| C. | 富集溴元素过程中,空气吹出法利用了溴易挥发的性质 | |
| D. | 若提取1 mol Br2,至少需要标准状况下22.4 L的Cl2 |