题目内容
2.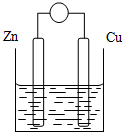 原电池是将化学能转变成电能的装置.原电池结构示意图(以Zn-Cu-稀H2SO4原电池为例)铜片和锌片作电极,稀硫酸做电解质溶液.
原电池是将化学能转变成电能的装置.原电池结构示意图(以Zn-Cu-稀H2SO4原电池为例)铜片和锌片作电极,稀硫酸做电解质溶液.填表:
| 电极 | 电极材料 | 电极反应式 | 反应类型 |
| 正极 | |||
| 负极 | |||
| 总反应式 | |||
②在同一个电池中两极反应时,“失去电子数”与“得到电子数”要相同.
(3)原电池工作时电子、离子运动方向.
①外电路(导线):电子从负极经导线流向正极
②原电池内电解质溶液中:阴离子流向负极,阳离子流向正极.
分析 利用置换反应Zn+H2SO4=ZnSO4+H2↑,设计原电池,锌为负极,铜为正极,工作时,正极发生还原反应:2H++2e-=H2↑,负极发生氧化反应:Zn-2e-=Zn2+,Zn逐渐溶解,在外电路,电子从负极锌流出经导线流向正极铜,在内电路,电解质溶液中阴离子移向负极,阳离子移向正极,据此分析解答.
解答 解:(1)原电池是将化学能转化为电能的装置,利用置换反应Zn+H2SO4=ZnSO4+H2↑,设计原电池,锌为负极,铜为正极,工作时,正极发生还原反应:2H++2e-=H2↑,负极发生氧化反应:Zn-2e-=Zn2+,
故答案为:
| 电极 | 电极材料 | 电极反应式 | 反应类型 |
| 正极 | 铜 | 2H++2e-=H2↑ | 还原反应 |
| 负极 | 锌 | Zn-2e-=Zn2+ | 氧化反应 |
| 总反应式 | Zn+2H+=Zn2++H2↑ | 氧化还原反应 | |
故答案为:增大;
(3)①原电池工作时,在外电路,电子从负极流出经导线流向正极,
故答案为:负;正;
②在内电路,电解质溶液中阴离子移向负极,阳离子移向正极,
故答案为:阴;阳.
点评 本题考查原电池工作原理,为高频考点,失电子发生氧化反应的金属作负极,在正极得电子发生还原反应的电解质溶液中的离子,正极材料不参加反应,题目难度不大.

练习册系列答案
 期末金牌卷系列答案
期末金牌卷系列答案 轻松课堂标准练系列答案
轻松课堂标准练系列答案
相关题目
2.已知NH4++AlO2-+2H2O═Al(OH)3↓+NH3•H2O,向含有等物质的量的NH4+、Al3+、H+混合溶液中,慢慢滴加NaOH溶液直至过量,并不断搅拌,发生以下离子反应:
①H++OH-═H2O ②Al(OH)3+OH-═AlO2-+2H2O
③Al3++3OH-═Al(OH)3↓ ④NH4++OH-═NH3•H2O
先后顺序正确的是( )
①H++OH-═H2O ②Al(OH)3+OH-═AlO2-+2H2O
③Al3++3OH-═Al(OH)3↓ ④NH4++OH-═NH3•H2O
先后顺序正确的是( )
| A. | ①→④→③→② | B. | ①→③→②→④ | C. | ①→②→③→④ | D. | ①→③→④→② |
13.可用于电动汽车的铝空气燃料电池,通常以NaCl溶液或NaOH溶液为电解质溶液,铝合金为负极,通入空气的一极为正极.下列说法正确的是( )
| A. | 两种情况下的正极反应都为O2+2H2O+4e-═4OH- | |
| B. | 以NaOH溶液为电解质溶液时,负极反应为Al+3OH--3e-═Al(OH)3↓ | |
| C. | 以NaOH溶液为电解质溶液时,电池工作过程中电解质溶液的碱性保持不变 | |
| D. | 电池工作时,电子通过外电路从正极流向负极 |
10.下列有关物质性质的比较,不正确的是( )
| A. | 金属性:Li>Na>K>Rb | B. | 酸性:HF<HCl<HBr<HI | ||
| C. | 微粒半径:K+>Na+>Mg2+>Al3+ | D. | 酸性:HClO4>H2SO4>H3PO4>H2SiO3 |
17.下列分子中,属于含有非极性键的分子是( )
| A. | H2O | B. | Cl2; | C. | CCl4; | D. | CO2 |
7.用一种试剂能鉴别苯酚、戊烯、己烷、乙醇四种溶液,这种试剂是( )
| A. | FeCl3 | B. | 溴水 | C. | 石蕊试液 | D. | KMnO4溶液 |
11.己知:30.0%氨水的密度为ρ1,20.0%氨水的密度为ρ2,现将二者等体积混合,混合后氨水的质量分数为
( )
( )
| A. | $\frac{{{ρ_1}+{ρ_2}}}{2}$ | B. | $\frac{30.0%+20.0%}{2}$ | C. | 小于25.0% | D. | 大于25.0% |