题目内容
15.质量分数为98%,密度为1.84g/cm3的浓硫酸,其物质的量浓度是(保留三位有效数字)18.4mol/L.分析 先计算出1L该浓硫酸中含有硫酸的质量,然后根据n=$\frac{m}{M}$计算出硫酸的物质的量,从而可知该浓硫酸的物质的量浓度.
解答 解:1L该浓硫酸中含有硫酸的质量为:1.84g/cm3×1000mL×98%=18032.2g,含有硫酸的物质的量为:$\frac{1803.2g}{98g/mol}$=18.4mol,
则该浓硫酸的物质的量浓度为:$\frac{18.4mol}{1L}$=18.4mol/L,
故答案为:18.4mol/L.
点评 本题考查了物质的量浓度的计算,题目难度不大,明确物质的量与摩尔质量、物质的量浓度之间的关系为解答关键,注意掌握物质的量浓度的概念及表达式,试题培养了学生的化学计算能力.

练习册系列答案
 天天向上口算本系列答案
天天向上口算本系列答案
相关题目
10.下列叙述正确的是( )
| A. | 将5.85gNaCl晶体溶入100mL水中,制得0.1mol/L的NaCl溶液 | |
| B. | 将25g无水硫酸铜粉末溶于水制成100mL溶液,其浓度为1mol/L | |
| C. | 将0.2mol/L稀硫酸与等质量的蒸馏水混合后,浓度大于0.1mol/L | |
| D. | 将1体积1mol/L的稀硫酸用水稀释到5体积,溶液的浓度为0.2mol/L |
20.某元素Y的核外电子数等于核内中子数,取2.8g该元素的单质与氧气充分反应,可得6.0g化合物YO2,则该元素在周期表中位置( )
| A. | 第三周期 | B. | 第一周期 | C. | 第ⅤA族 | D. | 第ⅥA族 |
7.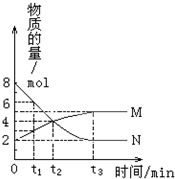 在一定温度下,密闭容器内某一反应中M、N两种气体的物质的量随反应时间的变化曲线如图,下列表述中正确的是( )
在一定温度下,密闭容器内某一反应中M、N两种气体的物质的量随反应时间的变化曲线如图,下列表述中正确的是( )
 在一定温度下,密闭容器内某一反应中M、N两种气体的物质的量随反应时间的变化曲线如图,下列表述中正确的是( )
在一定温度下,密闭容器内某一反应中M、N两种气体的物质的量随反应时间的变化曲线如图,下列表述中正确的是( )| A. | 反应的化学方程式为:N?2M | |
| B. | t2时,正逆反应速率相等,达到平衡 | |
| C. | t3时,保持恒温恒容,再充入N,N的转化率保持不变 | |
| D. | t3时,其他条件不变,改变温度,平衡一定发生移动 |
4.3.15g镁铝合金完全溶于稀硝酸.若反应中硝酸被还原只产生2.24L(标准状况下)NO气体,在反应后的溶液中加认足量1mo1•L-1的NaOH溶液.生成沉淀的质量为( )
| A. | 8.7g | B. | 3.15g | C. | 4.35g | D. | 4.0g |
18.钠硫电池作为一种新型储能电池,其应用逐渐得到重视和发展.
(1)Al(NO3)3是制备钠硫电池部件的原料之一.由于Al(NO3)3容易吸收环境中的水分,需要对其进行定量分析.具体步骤如图所示:
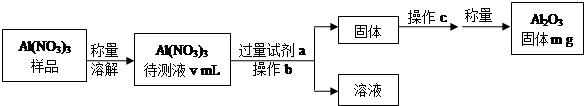
①加入试剂a后发生反应的离子方程式为Al3++3NH3•H2O═Al(OH)3↓+3NH4+.
②操作b为过滤,操作c为洗涤、灼烧(或加热)、冷却.
③Al(NO3)3待测液中,c (Al3+)=$\frac{1000m}{51v}$mol•L-1(用m、v表示).
(2)钠硫电池以熔融金属钠、熔融硫和多硫化钠(Na2Sx)分别作为两个电极的反应物,固体Al2O3陶瓷(可传导Na+)为电解质,其反应原理如图所示:
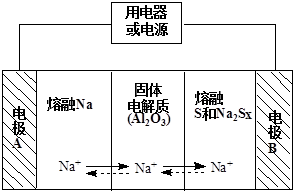
①根据下表数据,请你判断该电池工作的适宜温度应控制在c范围内(填字母序号).
a.100℃以下 b.100℃~300℃c.300℃~350℃d.350℃~2050℃
②放电时,电极A为负极.
③放电时,内电路中Na+的移动方向为从A到B(填“从A到B”或“从B到A”).
④充电时,总反应为Na2Sx═2Na+xS(3<x<5),则阳极的电极反应式为Sx2--2e-═xS.
(1)Al(NO3)3是制备钠硫电池部件的原料之一.由于Al(NO3)3容易吸收环境中的水分,需要对其进行定量分析.具体步骤如图所示:

①加入试剂a后发生反应的离子方程式为Al3++3NH3•H2O═Al(OH)3↓+3NH4+.
②操作b为过滤,操作c为洗涤、灼烧(或加热)、冷却.
③Al(NO3)3待测液中,c (Al3+)=$\frac{1000m}{51v}$mol•L-1(用m、v表示).
(2)钠硫电池以熔融金属钠、熔融硫和多硫化钠(Na2Sx)分别作为两个电极的反应物,固体Al2O3陶瓷(可传导Na+)为电解质,其反应原理如图所示:

①根据下表数据,请你判断该电池工作的适宜温度应控制在c范围内(填字母序号).
| 物质 | Na | S | Al2O3 |
| 熔点/℃ | 97.8 | 115 | 2050 |
| 沸点/℃ | 892 | 444.6 | 2980 |
②放电时,电极A为负极.
③放电时,内电路中Na+的移动方向为从A到B(填“从A到B”或“从B到A”).
④充电时,总反应为Na2Sx═2Na+xS(3<x<5),则阳极的电极反应式为Sx2--2e-═xS.
