题目内容
10.下列叙述正确的是( )| A. | 将5.85gNaCl晶体溶入100mL水中,制得0.1mol/L的NaCl溶液 | |
| B. | 将25g无水硫酸铜粉末溶于水制成100mL溶液,其浓度为1mol/L | |
| C. | 将0.2mol/L稀硫酸与等质量的蒸馏水混合后,浓度大于0.1mol/L | |
| D. | 将1体积1mol/L的稀硫酸用水稀释到5体积,溶液的浓度为0.2mol/L |
分析 A.氯化钠溶于100mL水中,所得溶液体积不是100mL;
B.无水硫酸铜的摩尔质量为160g/mol,25g无水硫酸铜的物质的量大于0.1mol;
C.硫酸浓度越小,溶于密度越小,混合液体积大于原溶液的2倍;
D.稀释过程中硫酸的物质的量不变,将1体积1mol/L的稀硫酸用水稀释到5体积,溶液浓度为原先的$\frac{1}{5}$.
解答 解:A.将5.85gNaCl晶体溶入100mL水中,所得溶液体积不是100mL,制得溶液浓度不是0.1mol/L,故A错误;
B.25g无水硫酸铜粉末的物质的量为:$\frac{25g}{160g/mol}$=$\frac{5}{32}$mol>0.1mol,则所得溶液浓度大于1mol/L,故B错误;
C.将0.2mol/L稀硫酸与等质量的蒸馏水混合后,混合液质量为原先2倍,而混合液密度减小,则所得溶液体积大于原先2倍,所得溶液浓度小于0.2mol/L×$\frac{1}{2}$=0.1mol/L,故C错误;
D.将1体积1mol/L的稀硫酸用水稀释到5体积,稀释过程中硫酸的物质的量不变,则稀释后溶液的浓度为:$\frac{1mol/L×1}{5}$=0.2mol/L,故D正确;
故选D.
点评 本题考查了物质的量浓度的计算,题目难度不大,明确物质的量浓度的概念及表达式为解答关键,A为易错点,注意溶液体积与水的体积不相等,试题培养了学生的化学计算能力.

练习册系列答案
相关题目
1.下列说法正确的是:(NA表示阿伏加德罗常数的值)( )
| A. | 28g氮气所含有的原子数目为NA | |
| B. | 6g金属镁变成镁离子时失去的电子数目为为NA | |
| C. | 标准状况下,22.4L任何气体所含分子数都约为NA | |
| D. | 50mL 1mol/L NaCl溶液所含的Cl-物质的量0.5NA |
18.下列说法正确的是( )
| A. | c(H+)=1×10-7mol/L的溶液一定是酸性 | |
| B. | 标况时,水本身电离出的c(H+)=1×10-13的溶液,可能是0.1mol•L-1的盐酸或0.1mol•L-1的NaOH溶液 | |
| C. | BaSO4难溶于水,是强电解质 | |
| D. | NH3•H2O的水溶液导电,所以NH3是电解质 |
5.关于3mol NO,下列说法正确的是( )
| A. | 质量为30 g | |
| B. | 含有6.02×1023个NO子 | |
| C. | 标准状况下的体积为67.2L | |
| D. | 与足量氧气完全反应,生成6mol NO2 |



 :CH2=CHCH3、CH2=CH2
:CH2=CHCH3、CH2=CH2 HOCH2CH2OH、
HOCH2CH2OH、 、H2N(CH2)4COOH.
、H2N(CH2)4COOH. $→_{H_{2}SO_{4}、丙酮、0℃}^{CrO_{3}}$B$→_{△}^{CH_{3}OH、H+}$
$→_{H_{2}SO_{4}、丙酮、0℃}^{CrO_{3}}$B$→_{△}^{CH_{3}OH、H+}$ $→_{过氧化物}^{HBr}$D$→_{②酸化}^{①NaOH溶液/△}$E$→_{△}^{浓H_{2}SO_{4}}$
$→_{过氧化物}^{HBr}$D$→_{②酸化}^{①NaOH溶液/△}$E$→_{△}^{浓H_{2}SO_{4}}$ 二氢荆芥内酯
二氢荆芥内酯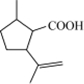 .
.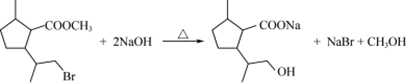 .
.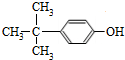 .
. 制备
制备 的合成路线图(无机试剂任选).合成路
的合成路线图(无机试剂任选).合成路