题目内容
6.某2.0L硫酸溶液中含有1.0mol H2SO4.试计算:(1)溶液中H2SO4的物质的量浓度;
(2)向上述溶液中加入足量的铁粉,产生气体的体积(标准状况);
(3)假设反应前后溶液体积不变,则所得溶液中Fe2+的物质的量浓度.
分析 (1)根据c=$\frac{n}{V}$计算溶液的浓度;
(2)根据反应的方程式列式计算,反应为:Fe+H2SO4=FeSO4+H2↑;
(3)反应后溶液成分为FeSO4,根据SO42-的物质的量计算.
解答 解:(1)c(H2SO4)=$\frac{1.0mol}{2L}$=0.5mol/L,
答:溶液中H2SO4的物质的量浓度为0.5mol/L;
(2)根据反应的方程式列式计算:
Fe+H2SO4=FeSO4+H2↑
1mol 22.4 L
1.0 mol V(H2)
V(H2)=$\frac{1.0mol×22.4L}{1mol}$=22.4L,
答:产生气体的体积为22.4L;
(3)n(Fe2+)=n(SO42-)=1.0 mol
c(Fe2+)=$\frac{1.0mol}{2L}$L=0.5 mol/L
答:所得溶液中Fe2+的物质的量浓度为0.5 mol/L.
点评 本题考查化学方程式的计算,题目难度不大,注意有关计算公式的运用以及反应方程式的书写.

练习册系列答案
相关题目
16.2008年北京奥运会“祥云”火炬用的是环保型燃料--丙烷(C3H8),悉尼奥运会火炬所用燃料为65%丁烷(C4H10)和35%丙烷,下列有关说法正确的是( )
| A. | 丁烷的一氯代物有5种 | B. | 丙烷分子中所有原子共平面 | ||
| C. | 符合通式CnH2n+2的均属于烷烃 | D. | 以上说法均不正确 |
1.下列说法正确的是:(NA表示阿伏加德罗常数的值)( )
| A. | 28g氮气所含有的原子数目为NA | |
| B. | 6g金属镁变成镁离子时失去的电子数目为为NA | |
| C. | 标准状况下,22.4L任何气体所含分子数都约为NA | |
| D. | 50mL 1mol/L NaCl溶液所含的Cl-物质的量0.5NA |
18.下列说法正确的是( )
| A. | c(H+)=1×10-7mol/L的溶液一定是酸性 | |
| B. | 标况时,水本身电离出的c(H+)=1×10-13的溶液,可能是0.1mol•L-1的盐酸或0.1mol•L-1的NaOH溶液 | |
| C. | BaSO4难溶于水,是强电解质 | |
| D. | NH3•H2O的水溶液导电,所以NH3是电解质 |
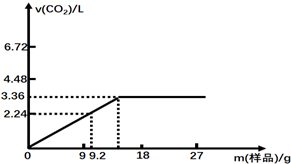

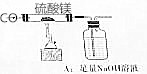 确定反应的化学方程式和制得的MgO的纯度,称量MgSO410.0g,放置于石英管中,按右图连接装置进行试验.试验步骤如下:
确定反应的化学方程式和制得的MgO的纯度,称量MgSO410.0g,放置于石英管中,按右图连接装置进行试验.试验步骤如下: