题目内容
18.钠硫电池作为一种新型储能电池,其应用逐渐得到重视和发展.(1)Al(NO3)3是制备钠硫电池部件的原料之一.由于Al(NO3)3容易吸收环境中的水分,需要对其进行定量分析.具体步骤如图所示:
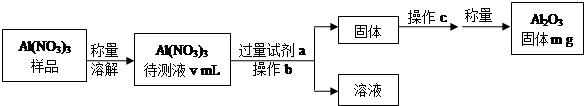
①加入试剂a后发生反应的离子方程式为Al3++3NH3•H2O═Al(OH)3↓+3NH4+.
②操作b为过滤,操作c为洗涤、灼烧(或加热)、冷却.
③Al(NO3)3待测液中,c (Al3+)=$\frac{1000m}{51v}$mol•L-1(用m、v表示).
(2)钠硫电池以熔融金属钠、熔融硫和多硫化钠(Na2Sx)分别作为两个电极的反应物,固体Al2O3陶瓷(可传导Na+)为电解质,其反应原理如图所示:
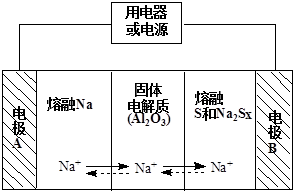
①根据下表数据,请你判断该电池工作的适宜温度应控制在c范围内(填字母序号).
| 物质 | Na | S | Al2O3 |
| 熔点/℃ | 97.8 | 115 | 2050 |
| 沸点/℃ | 892 | 444.6 | 2980 |
②放电时,电极A为负极.
③放电时,内电路中Na+的移动方向为从A到B(填“从A到B”或“从B到A”).
④充电时,总反应为Na2Sx═2Na+xS(3<x<5),则阳极的电极反应式为Sx2--2e-═xS.
分析 样品称量溶解得到待测溶液,加入过量一水合氨溶液,Al(NO3)3和氨水反应生成Al(OH)3,经过滤、洗涤、灼烧后生成Al2O3,根据Al2O3的质量可确定的Al(NO3)3待测液中,c(Al3+),
(1)由操作流程可知实验原理是Al(NO3)3和氨水反应生成Al(OH)3,经过滤、洗涤、灼烧后生成Al2O3,根据Al2O3的质量可确定的Al(NO3)3待测液中,c(Al3+);
(2)原电池工作时,控制的温度应为满足Na、S为熔融状态,Na被氧化,应为原电池负极,阳离子向正极移动,充电时,阳极反应为原电池正极反应的逆反应,应生成S,以此解答.
解答 解:(1)①由操作流程可知实验原理是Al(NO3)3和氨水反应生成Al(OH)3,试剂a为氨水,反应的方程式为Al3++3NH3•H2O═Al(OH)3↓+3NH4+,
故答案为:Al3++3NH3•H2O═Al(OH)3↓+3NH4+;
②Al(OH)3经过滤、洗涤、灼烧后生成Al2O3,冷却后称量,
故答案为:过滤;洗涤、灼烧(或加热)、冷却;
③n(Al2O3)=$\frac{mg}{102g/mol}$=$\frac{m}{102}$mol,
则n(Al(NO3)3)=2n(Al2O3)=$\frac{m}{51}$mol,
c(Al(NO3)3)=$\frac{\frac{m}{51}mol}{v×1{0}^{-3}L}$=$\frac{1000m}{51v}$mol/L,
故答案为:$\frac{1000m}{51v}$;
(2)①原电池工作时,控制的温度应为满足Na、S为熔融状态,则温度应高于115℃而低于444.6℃,只有c符合,
故答案为:c;
②放电时,Na被氧化,应为原电池负极,故答案为:负;
③阳离子向正极移动,即从A到B,故答案为:从A到B;
④充电时,是电解池反应,阳极反应为:Sx2--2e-=xS,故答案为:Sx2--2e-═xS.
点评 本题考查较为综合,涉及物质的分离、提纯以及含量的测定和原电池知识,侧重于学生的分析能力、实验能力、计算能力的考查,为高频考点,注意相关基础知识的积累,题目难度中等.

 口算心算速算应用题系列答案
口算心算速算应用题系列答案 同步拓展阅读系列答案
同步拓展阅读系列答案 短周期元素R、T、Q、W在元素周期表中的相对位置如图所示,其中T所处的周期序数与族序数相等.下列判断不正确的是( )
短周期元素R、T、Q、W在元素周期表中的相对位置如图所示,其中T所处的周期序数与族序数相等.下列判断不正确的是( )| A. | 最简单气态氢化物的热稳定性:R>Q | |
| B. | 最高价氧化物对应水化物的酸性:Q<W | |
| C. | 原子半径:T>Q>R | |
| D. | 简单离子半径:T>R |
I.取5mL 0.1mol/L的KI溶液,滴加5-6滴FeCl3稀溶液;
Ⅱ.继续加入2mL CCl4,盖好玻璃塞,振荡静置.
Ⅲ.取少量分液后得到的上层清液,滴加KSCN溶液.
Ⅳ.移取25.00mLFeCl3稀溶液至锥形瓶中,加入KSCN溶液用作指示剂,再用c mol/LKI标准溶液滴定,达到滴定终点.重复滴定三次,平均耗用c mol/LKI标准溶液VmL.
(1)探究活动I中发生反应的离子方程式为2Fe3++2I-=2Fe2++I2 .
请将探究活动Ⅱ中“振荡静置”后得到下层液体的操作补充完整:将分液漏斗放在铁架台上,静置.
待液体分层后,将分液漏斗颈上的玻璃塞打开,或使玻璃塞上的凹槽(或小孔)对准分液漏斗上的小孔,再将分液漏斗下面的活塞拧开,使下层液体慢慢沿烧杯壁流下.
(2)探究活动Ⅲ的意图是通过生成红色的溶液(假设溶质全部为Fe(SCN)3),验证有Fe3+残留,从而证明化学反应有一定的限度,但在实验中却未见溶液呈红色.对此同学们提出了下列两种猜想:
猜想一:Fe3+全部转化为Fe2+
猜想二:生成的Fe(SCN)3浓度极小,其颜色肉眼无法观察.
为了验证猜想,查阅资料获得下列信息:
信息一:乙醚微溶于水,密度为0.71g/mL,Fe(SCN)3在乙醚中的溶解度比在水中大;
信息二:Fe3+可与[Fe(CN)6]4-反应生成暗蓝色沉淀,用K4[Fe(CN)6](亚铁氰化钾)溶液检验Fe3+的灵敏度比用KSCN溶液更高.
结合新信息,现设计以下实验方案验证猜想:
①请完成如表
| 实验操作 | 现象和结论 |
| 步骤一:取萃取后得到的上层清液,加入2滴K4[Fe(CN)6](亚铁氰化钾)溶液 | 若产生暗蓝色沉淀,则猜想一不成立. |
| 步骤二:取探究Ⅲ中所得溶液,加入少量乙醚,充分振荡,静置分层 | 若乙醚层呈红色,则猜想二成立. |
(3)根据探究活动Ⅳ,FeCl3稀溶液物质的量浓度为0.04cVmol/L.
| A. | 加入NaHCO3溶液产生气体,表示含有-COOH或酚羟基 | |
| B. | 遇浓硝酸变黄,则表明该物质是含有苯环结构的蛋白质 | |
| C. | 加入新制的Cu(OH)2悬浊液,加热煮沸有红色沉淀生成,或加入银氨溶液加热有银镜生成,表示含有-CHO | |
| D. | 某有机物与醋酸反应,相对分子质量增加42,则含有1个-OH;增加84,则含有2个-OH |
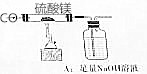 确定反应的化学方程式和制得的MgO的纯度,称量MgSO410.0g,放置于石英管中,按右图连接装置进行试验.试验步骤如下:
确定反应的化学方程式和制得的MgO的纯度,称量MgSO410.0g,放置于石英管中,按右图连接装置进行试验.试验步骤如下: $→_{H_{2}SO_{4}、丙酮、0℃}^{CrO_{3}}$B$→_{△}^{CH_{3}OH、H+}$
$→_{H_{2}SO_{4}、丙酮、0℃}^{CrO_{3}}$B$→_{△}^{CH_{3}OH、H+}$ $→_{过氧化物}^{HBr}$D$→_{②酸化}^{①NaOH溶液/△}$E$→_{△}^{浓H_{2}SO_{4}}$
$→_{过氧化物}^{HBr}$D$→_{②酸化}^{①NaOH溶液/△}$E$→_{△}^{浓H_{2}SO_{4}}$ 二氢荆芥内酯
二氢荆芥内酯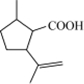 .
.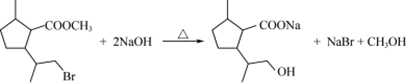 .
.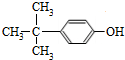 .
. 制备
制备 的合成路线图(无机试剂任选).合成路
的合成路线图(无机试剂任选).合成路
 ;
; ;
; ;
; .
. 某物质只含C、H、O三种元素,其分子模型如图所示,分子中共有12个原子(图中球与球之间的连线代表单键、双键等化学键).
某物质只含C、H、O三种元素,其分子模型如图所示,分子中共有12个原子(图中球与球之间的连线代表单键、双键等化学键).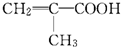 .
. $\stackrel{一定条件}{→}$
$\stackrel{一定条件}{→}$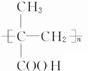 .
.