题目内容
20.某元素Y的核外电子数等于核内中子数,取2.8g该元素的单质与氧气充分反应,可得6.0g化合物YO2,则该元素在周期表中位置( )| A. | 第三周期 | B. | 第一周期 | C. | 第ⅤA族 | D. | 第ⅥA族 |
分析 2.8g该元素的单质与氧气充分反应,可得6.0g化合物YO2,则2.8g单质与3.2g氧气反应,n(O2)=$\frac{3.2g}{32g/mol}$=0.1mol,由R+O2=RO2可知,M(R)=$\frac{2.8g}{0.1mol}$=28g/mol,再结合核外电子数等于核内中子数来解答.
解答 解:2.8g该元素的单质与氧气充分反应,可得6.0g化合物YO2,则2.8g单质与3.2g氧气反应,n(O2)=$\frac{3.2g}{32g/mol}$=0.1mol,由R+O2=RO2可知,M(R)=$\frac{2.8g}{0.1mol}$=28g/mol,又核外电子数等于核内中子数,则质子数为14,为Si元素,位于元素周期表的第三周期ⅣA族,
故选A.
点评 本题考查元素周期表的结构及应用,把握物质的量的相关计算及R质子数的确定为解答的关键,侧重分析能力、计算能力的考查,题目难度不大.

练习册系列答案
 春雨教育同步作文系列答案
春雨教育同步作文系列答案
相关题目
8.向氢氧化铁溶胶中逐滴加入一种液体,首先使溶胶发生聚沉而沉淀,继续加入时沉淀消失.这种液体是( )
| A. | 0.5mol•L-1食盐溶液 | B. | 0.5mol•L-1NaHSO4溶液 | ||
| C. | 0.5mol•L-1氯化钾溶液 | D. | 蒸馏水 |
5.固体粉末X中可能含有K2SO3、K2CO3、FeO、Fe2O3、MnO2、Na2SO4中的若干种,为确定该固体粉末的成分,现取X进行连续实验,实验过程及产物如图:
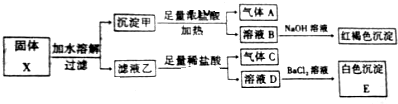
根据上述实验,下列说法中正确的是( )

根据上述实验,下列说法中正确的是( )
| A. | 固体X中一定含有Fe2O3 | B. | 沉淀E可能含有BaSO3 | ||
| C. | 气体A、C一定均为纯净物 | D. | 固体X可能出现含有K2SO3、K2CO3 |
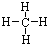 ;(3)O2O=O.
;(3)O2O=O.

 +H2O(R、R′为H或烃基)
+H2O(R、R′为H或烃基)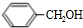 ;C中含有的官能团碳碳双键和醛基(写名称).
;C中含有的官能团碳碳双键和醛基(写名称). .
. .
.



 ;
; ;
; ;
; .
.