题目内容
10.洋植物如海带、海藻中含有丰富的碘元素,主要以碘化物形式存在.有一化学课外小组用海带为原料制取少量碘单质,他们将海带灼烧成灰,用水浸泡一段时间(以让碘化物充分溶解在水中),得到海带灰悬浊液,然后按以下实验流程提取单质碘: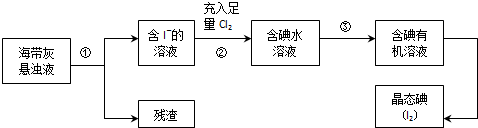
(提示:Cl2和I-可发生置换反应)
(1)灼烧海带时需要用到的实验仪器是ABCDE(从下列仪器中选出所需的仪器,用标号字母填写在空白处).
A.坩埚 B.坩埚钳 C.三脚架 D.泥三角E.酒精灯
(2)过程②中充入足量Cl2的目的是将I-全部氧化为I2,反应的离子方程式为Cl2+2I-=2Cl-+I2.
(3)操作③中所用的有机试剂可以是CCl4(只填一种).
(4)操作过程③可以分解为如下几步:
A.把盛有溶液的分液漏斗放在铁架台的铁圈中;
B.把50mL碘水和15mL有机溶剂(你所选)加入分液漏斗中,盖好玻璃塞;
C.检验分液漏斗活塞和上口的玻璃塞是否漏液;
D.倒转漏斗用力振荡,不时旋开活塞放气,后关闭活塞,把分液漏斗放正;
E.旋开活塞,用烧杯接收溶液;
F.从分液漏斗上口倒出上层液体;
G.将漏斗上口的玻璃塞打开或使塞上的凹槽与漏斗上口的小孔对准;
H.静置、分层.
a.上述G步操作的目的是保持分液漏斗内外压力平衡,使液体易于流下;
b.最后碘的有机溶液是通过选苯则填“漏斗上口,选CCl4则填“漏斗下口获得(填“漏斗上口”或“漏斗下口”).
(5)若要检验提取碘后的水溶液中是否还含有单质碘,可以取样加入淀粉溶液,观察颜色变化.
(6)从含碘的有机溶液中提取碘和回收有机溶液,还需要经过蒸馏,观察图所示实验装置,指出其错误有3处.
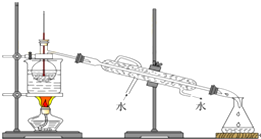
(7)进行上述蒸馏操作时,使用水浴的原因是受热比较均匀,温度容易控制.
分析 海带灰悬浊液过滤得到含I-的溶液,溶液中充入足量的氯气氧化碘离子为碘单质,加入萃取剂萃取分液得到含碘有机溶液,蒸馏得到碘单质,
(1)根据仪器的作用选取仪器,灼烧用坩埚,转移坩埚用坩埚钳,用带铁圈的铁架台或三脚架和泥三角上放置坩埚,用酒精灯进行加热;
(2)过滤后的滤液中含碘离子,充入足量Cl2可以被氧化为碘单质;
(3)萃取剂的选取标准是:溶质在萃取剂中的溶解度大于在原溶剂中的溶解度,溶质和萃取剂不反应,萃取剂和原来溶剂不能互溶;
(4)a.不打开活塞,液体在大气压作用下无法流出;
b.上层液体从上口倒出,下层液体从下口流出;
(5)根据碘单质遇到淀粉会变蓝色来检验是否还有碘单质;
(6)冷凝水应是下进上出,温度计水银球应与烧瓶支管口相平,大面积加热玻璃仪器需要垫石棉网;
(7)水浴加热的温度是使试管内或烧杯内试剂受热温度均匀,具有长时间加热温度保持恒定的特点.
解答 解:(1)灼烧海带时用坩埚盛放海带,用带铁圈的铁架台或三脚架和泥三角上放置坩埚,用酒精灯进行加热,所以灼烧海带时需要用到的实验仪器是坩埚、带铁圈的铁架台或三脚架、泥三角、酒精灯,用坩埚钳转移坩埚,无需使用烧杯,
故答案为:ABCDE;
(2)步骤②用氯气置换碘离子,其反应离子方程式为Cl2+2I-=I2+2Cl-;
故答案为:使I-转化为I2,Cl2+2I-=I2+2Cl-;
(3)碘在萃取剂CCl中的溶解度大于在原溶剂水中的溶解度,碘和四氯化碳不反应,四氯化碳和水不能互溶,所以可以用四氯化碳作萃取剂,
故答案为:CCl4;
(4)a.不打开活塞,液体在大气压作用下无法流出,
故答案为:保持分液漏斗内外压力平衡,使液体易于流下;
b.上层液体从上口倒出,下层液体从下口流出;CCl4 的密度大于水的密度,故从漏斗下口流出,
故答案为:漏斗下口;
(5)提取碘后的水溶液中若是含有单质碘,则遇到淀粉会变蓝色,可以取少量提取碘后的水溶液于试管中,加入几滴淀粉试液,观察是否出现蓝色(如果变蓝,说明还有单质碘),
故答案为:淀粉溶液;
(6)冷凝水应是下进上出,温度计测量蒸气的温度,温度计水银球应与烧瓶支管口相平,烧杯加热需要垫石棉网,其错误有3处,
故答案为:3;
(7)水浴加热的温度是使试管内或烧杯内试剂受热温度均匀,具有长时间加热温度保持恒定的特点,四氯化碳沸点:76.8℃,碘单质沸点为184℃,所以最后晶态碘在蒸馏烧瓶里聚集,
故答案为:受热比较均匀,温度容易控制;
点评 本题考查了海水资源的综合利用,为高频考点,涉及知识点较多,把握实验流程及发生的反应、萃取剂的选取标准、蒸馏实验原理及装置等知识点为解答的关键,侧重高频考点的考查,题目难度中等.

| A. | 这种饮料中不含任何化学物质 | |
| B. | 没有水就没有生命 | |
| C. | 这种口服液含丰富的氮、磷、锌等微量元素 | |
| D. | 这种蒸馏水绝对纯净,其中不含任何离子 |
| A. | 1:2:l | B. | 2:2:1 | C. | 2:3:l | D. | 4:3:2 |
