题目内容
15.有200mL氯化镁和氯化铝的混合溶液,其中c(Mg2+)为0.2mol/L,c(Cl-)为1.3mol/L,则Al3+的物质的量浓度为0.3mol/L.分析 溶液呈电中性,根据电荷守恒:2c(Mg2+)+3c(Al3+)=c(Cl-).
解答 解:溶液呈电中性,根据电荷守恒:2c(Mg2+)+3c(Al3+)=c(Cl-),则:
2×0.2mol/L+3c(Al3+)=1.3mol/L
解得c(Al3+)=0.3 mol/L,
故答案为:0.3.
点评 本题考查物质的量浓度计算,难度不大,注意电解质混合溶液中常利用电荷守恒计算离子浓度.

练习册系列答案
 中考解读考点精练系列答案
中考解读考点精练系列答案 各地期末复习特训卷系列答案
各地期末复习特训卷系列答案
相关题目
6.短周期元素X、Y、Z、W、Q在元素周期表中的相对位置如图所示.下列说法正确的是( )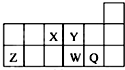

| A. | 元素Y的单质比元素X的单质更容易与氢气反应 | |
| B. | 原子半径的大小顺序为:rX>rY>rZ>rW>rQ | |
| C. | 离子Y2-和Z3+的核外电子数和电子层数都不相同 | |
| D. | 元素W的最高价氧化物对应的水化物的酸性比Q的强 |
3.下列各组的两种物质在溶液中的反应,可用同一离子方程式表示的是( )
| A. | 氢氧化钠与盐酸; 氢氧化钠与碳酸 | |
| B. | BaCl2溶液与Na2SO4溶液; Ba(OH)2溶液与H2SO4溶液 | |
| C. | Na2CO3溶液与硝酸溶液; CaCO3溶液与硝酸溶液 | |
| D. | 石灰石与硝酸反应; 石灰石与盐酸 |
7.下列化学实验事实及其解释或得出的结论都正确的是( )
| A. | 向SO2 水溶液中滴加盐酸酸化的BaCl2 溶液,有白色沉淀生成,说明BaSO4难溶于盐酸 | |
| B. | 向某溶液中加入稀盐酸,产生的气体通入澄清石灰水,石灰水变浑浊,该溶液一定是碳酸盐溶液 | |
| C. | 向0.1mol•L-1 FeSO4 溶液中滴加少量酸性KMnO4 溶液,紫红色KMnO4 溶液褪色,说明Fe2+具有还原性 | |
| D. | 向某溶液中滴加NaOH溶液,未产生使湿润的红色石蕊试纸变蓝的气体,该溶液中一定不含NH4+ |
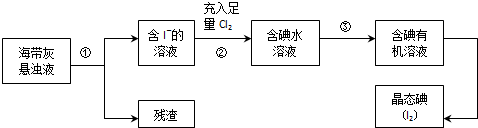
 随原子序数的递增,八种短周期元素(用字母表示)原子半径的相对大小、最高正价或最低负价的变化如下图所示.
随原子序数的递增,八种短周期元素(用字母表示)原子半径的相对大小、最高正价或最低负价的变化如下图所示. (或
(或
 ).
). 卷心菜中含有丰富的维生素C,维生素C在酸性溶液中能被碘氧化.某实验小组通过如下实验对卷心菜中维生素C的含量进行测定.
卷心菜中含有丰富的维生素C,维生素C在酸性溶液中能被碘氧化.某实验小组通过如下实验对卷心菜中维生素C的含量进行测定.