题目内容
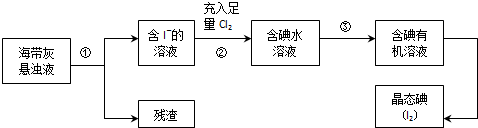
18.某校研究性学习小组用已部分生锈(Fe2O3)的废铁屑,制作印刷电路板的腐蚀剂,即FeCl3溶液.研究过程如图:
根据要求回答问题:
(1)用浓盐酸配制100ml 1mol.L-1稀盐酸,需要的玻璃仪器:烧杯、胶头滴管、量筒、玻璃棒、还有100mL容量瓶,用量筒量取一定体积的浓盐酸时,仰视会造成稀盐酸的浓度偏大(填偏大、偏小、不变).
(2)用KSCN溶液检验溶液中Fe3+存在的离子方程式:Fe3++3SCN-=Fe(SCN)3;
证明Fe3+存在的实验现象是:溶液变红色;
(3)甲同学认为:废铁屑加入适量的盐酸后,除了铁锈和铁都能与稀盐酸反应以外,同时还发生另一个反应,则这个反应的离子方程式为:Fe+2Fe3+=3Fe2+;
(4)写出A→B反应的离子方程式:2Fe2++Cl2=2Fe3++2Cl-
B→C变化中,写出FeCl3溶液与金属铜发生反应的化学方程式:2FeCl3+Cu=2FeCl2+CuCl2.
(5)为了对C溶液回收利用,向C溶液中加入一定量的铁粉,充分反应后,如果溶液内有较多Cu2+和相当量的Cu,则容器内不可能有的金属或金属离子Fe3+、Fe.
分析 废铁屑含有氧化铁、铁,加入盐酸,三氧化二铁与盐酸反应生成氯化铁和水,铁与盐酸反应生成氯化亚铁,通入氯气将氯化亚铁氧化生成氯化铁,氯化铁能够与铜反应生成氯化亚铁和氯化铜.
(1)根据配制步骤是计算、称量、溶解、冷却、移液、洗涤、定容、摇匀、装瓶来分析需要的仪器;量取浓盐酸时仰视会使量取的体积偏大;
(2)三价铁离子与硫氰根离子发生络合反应生成红色硫氰合铁络合物;Fe3+遇到KSCN溶液会变红色;
(3)三氧化二铁与盐酸反应生成氯化铁和水,氯化铁具有强的氧化性,能够氧化铁生成二价铁离子;
(4)氯化亚铁与氯气发生氧化反应生成氯化铁;FeCl3溶液与金属铜反应生成氯化亚铁和氯化铜;
(5)氧化性:Fe3+>Cu2+>Fe2+,还原性Fe>Cu,根据物质之间的反应判断.
解答 解:(1)用浓盐酸配制100ml 1mol.L-1稀盐酸,根据配制步骤是计算、称量、溶解、冷却、移液、洗涤、定容、摇匀、装瓶可知所需的仪器为烧杯、胶头滴管、量筒、玻璃棒、100mL容量瓶;量取浓盐酸时仰视会使量取的体积偏大,则HCl的物质的量偏大,所以配制的稀盐酸的浓度偏大;
故答案为:100mL容量瓶;偏大;
(2)三价铁离子与硫氰根离子发生络合反应生成红色硫氰合铁络合物,离子方程式为Fe3++3SCN-=Fe(SCN)3,Fe3+遇到KSCN溶液会变红色,溶液变红色说明Fe3+存在;
故答案为:Fe3++3SCN-=Fe(SCN)3;溶液变红色;
(3)三氧化二铁与盐酸反应生成氯化铁和水,氯化铁具有强的氧化性,能够氧化铁生成二价铁离子,离子方程式:Fe+2Fe3+=3Fe2+;
故答案为:Fe+2Fe3+=3Fe2+;
(4)氯化亚铁与氯气发生氧化反应生成氯化铁,离子方程式程式:2Fe2++Cl2=2Fe3++2Cl-,FeCl3溶液与金属铜反应生成氯化亚铁和氯化铜,其反应的化学方程式为:2FeCl3+Cu=2FeCl2+CuCl2;
故答案为:2Fe2++Cl2=2Fe3++2Cl-;2FeCl3+Cu=2FeCl2+CuCl2;
(5)氧化性:Fe3+>Cu2+>Fe2+,还原性Fe>Cu,向C溶液中加入一定量的铁粉,充分反应后,如果溶液内有较多Cu2+和相当量的Cu,Fe3+能氧化Cu,则溶液中不能有Fe3+,Cu2+能氧化Fe,则不能有Fe,所以不能存在Fe3+、Fe;
故答案为:Fe3+、Fe.
点评 本题考查了金属元素化合物的性质,题目涉及溶液的配制、误差分析、物质的检验、离子方程式的书写等,题目综合性较强,难度中等,侧重于考查学生对基础知识的综合应用能力.

 通城学典默写能手系列答案
通城学典默写能手系列答案| A. | 原子数 | B. | 分子数 | C. | 质量 | D. | 密度 |
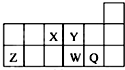
| A. | 元素Y的单质比元素X的单质更容易与氢气反应 | |
| B. | 原子半径的大小顺序为:rX>rY>rZ>rW>rQ | |
| C. | 离子Y2-和Z3+的核外电子数和电子层数都不相同 | |
| D. | 元素W的最高价氧化物对应的水化物的酸性比Q的强 |
| A. | 氢氧化钠与盐酸; 氢氧化钠与碳酸 | |
| B. | BaCl2溶液与Na2SO4溶液; Ba(OH)2溶液与H2SO4溶液 | |
| C. | Na2CO3溶液与硝酸溶液; CaCO3溶液与硝酸溶液 | |
| D. | 石灰石与硝酸反应; 石灰石与盐酸 |
| A. | 向SO2 水溶液中滴加盐酸酸化的BaCl2 溶液,有白色沉淀生成,说明BaSO4难溶于盐酸 | |
| B. | 向某溶液中加入稀盐酸,产生的气体通入澄清石灰水,石灰水变浑浊,该溶液一定是碳酸盐溶液 | |
| C. | 向0.1mol•L-1 FeSO4 溶液中滴加少量酸性KMnO4 溶液,紫红色KMnO4 溶液褪色,说明Fe2+具有还原性 | |
| D. | 向某溶液中滴加NaOH溶液,未产生使湿润的红色石蕊试纸变蓝的气体,该溶液中一定不含NH4+ |
| A. | C原子的轨道表示式: | |
| B. | N原子轨道表示式: | |
| C. | Cr基态原子核外电子排布式:[Ar]3d54s1 | |
| D. | Ca原子的电子排布式:[Ar]3d2 |
 .反应I除生成两种正盐外,还有水生成,其化学方程式为COS+4NaOH=Na2S+Na2CO3+2H2O已知反应II的产物X的溶液中硫元素的主要存在形式为S2O32-,则II中主要反应的离子方程式为2S2-+5H2O=S2O32-+4H2↑+2OH-.
.反应I除生成两种正盐外,还有水生成,其化学方程式为COS+4NaOH=Na2S+Na2CO3+2H2O已知反应II的产物X的溶液中硫元素的主要存在形式为S2O32-,则II中主要反应的离子方程式为2S2-+5H2O=S2O32-+4H2↑+2OH-.