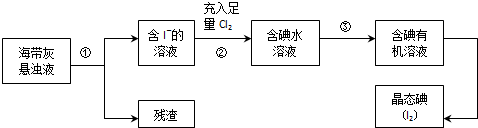
题目内容
1.工业上为了处理含有Cr2O72-酸性工业废水,采用下面的处理方法:往工业废水中加入适量的NaCl,以Fe为电极进行电解,经过一段时间,有Cr(OH)3和Fe(OH)3沉淀生成,工业废水中铬(Cr)的含量已低于排放标准.请回答下列问题:(1)电极反应式:阳极Fe-2e-═Fe2+;2H++2e-═H2↑
(2)写出Cr2O72-变为Cr3+的离子方程式6Fe2++Cr2O72-+14H+═6Fe3++2Cr3++7H2O
(3)工业废水pH升高的原因阴极反应消耗H+,溶液中的氧化还原反应也消耗H+,使溶液pH升高
(4)不能(填“能”或“不能”)改用石墨电极,原因若用石墨做电极,则无法产生还原剂Fe2+,使Cr2O72-还原为Cr3+,变成沉淀除去.
分析 (1)Fe为电极进行电解时,阳极上铁失电子发生氧化反应,阴极上氢离子放电生成氢气,同时阴极附近有氢氧根离子生成;
(2)酸性条件下,Cr2O72-和亚铁离子发生氧化还原反应,生成铁离子和铬离子;
(3)阴极上及发生氧化还原都消耗氢离子;
(4)如果改用石墨作电极,则阳极不能生成亚铁离子,导致无法生成铬离子.
解答 解:(10Fe为电极进行电解时,阳极是活泼电极,则电极本身发生失电子的氧化反应,即Fe-2e-═Fe2+,阴极上氢离子得电子发生还原反应,即2H++2e-═H2↑,
故答案为:Fe-2e-═Fe2+;2H++2e-═H2↑;
(2)Cr2O72-具有强氧化性,可以将亚铁离子氧化为铁离子,自身被还原为2Cr3+,反应的实质是:6Fe2++Cr2O72-+14H+═6Fe3++2Cr3++7H2O,
故答案为:6Fe2++Cr2O72-+14H+═6Fe3++2Cr3++7H2O;
(3)阴极反应消耗H+,溶液中的氧化还原反应也消耗H+,导致溶液中氢离子浓度降低,从而使溶液pH升高,
故答案为:阴极反应消耗H+,溶液中的氧化还原反应也消耗H+,使溶液pH升高;
(4)若用石墨做电极,则无法产生还原剂Fe2+,从而使Cr2O72-无法还原为Cr3+变成沉淀除去,所以不能用石墨作电极,
故答案为:不能;若用石墨做电极,则无法产生还原剂Fe2+,使Cr2O72-还原为Cr3+,变成沉淀除去.
点评 本题考查了电解池原理,涉及物质的分离和提纯、氧化还原反应等知识点,明确各个电极上发生的反应是解本题关键,注意:活泼金属作阳极时,阳极上金属失电子而不是溶液中阴离子失电子,为易错点,题目难度中等.

练习册系列答案
相关题目
6.短周期元素X、Y、Z、W、Q在元素周期表中的相对位置如图所示.下列说法正确的是( )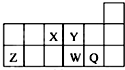

| A. | 元素Y的单质比元素X的单质更容易与氢气反应 | |
| B. | 原子半径的大小顺序为:rX>rY>rZ>rW>rQ | |
| C. | 离子Y2-和Z3+的核外电子数和电子层数都不相同 | |
| D. | 元素W的最高价氧化物对应的水化物的酸性比Q的强 |
11.加热蒸干下列盐溶液,可得到原溶质的是( )
| A. | FeCl3 | B. | Na2CO3 | C. | K2SO3 | D. | TiCl4 |
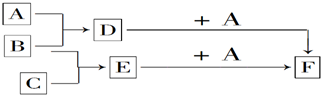
 .反应I除生成两种正盐外,还有水生成,其化学方程式为COS+4NaOH=Na2S+Na2CO3+2H2O已知反应II的产物X的溶液中硫元素的主要存在形式为S2O32-,则II中主要反应的离子方程式为2S2-+5H2O=S2O32-+4H2↑+2OH-.
.反应I除生成两种正盐外,还有水生成,其化学方程式为COS+4NaOH=Na2S+Na2CO3+2H2O已知反应II的产物X的溶液中硫元素的主要存在形式为S2O32-,则II中主要反应的离子方程式为2S2-+5H2O=S2O32-+4H2↑+2OH-.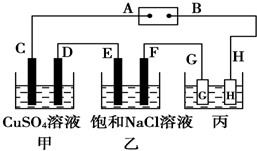 如图所示的装置,C、D、E、F都是惰性 电极.将电源接通后,向乙中滴入酚酞试液,在F极附近显红色.试回答以下问题:
如图所示的装置,C、D、E、F都是惰性 电极.将电源接通后,向乙中滴入酚酞试液,在F极附近显红色.试回答以下问题: