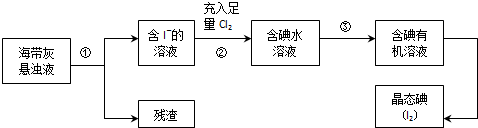
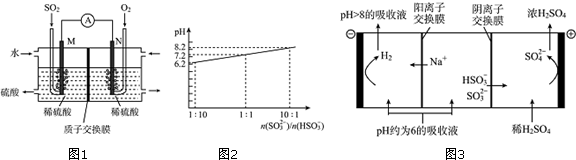
题目内容
19.在一定条件下,分别以高锰酸钾、氯酸钾、过氧化氢(H2O2)为原料制取氧气,当制得同温、同压下相同体积的O2时,三个反应中转移的电子数之比为( )| A. | 1:2:l | B. | 2:2:1 | C. | 2:3:l | D. | 4:3:2 |
分析 用高锰酸钾、氯酸钾制氧气,反应过程中O由-2价转化为0价,而用过氧化氢制氧气,O则由-1价转化为0价.现要制得相同的O2,所以用过氧化氢制氧气的反应中转移的电子数只有用高锰酸钾、氯酸钾制取的反应中转移的电子数的一半.
解答 解:用高锰酸钾、氯酸钾制氧气,反应过程中O由-2价转化为0价,如生成1mol O2,需转移4mol电子,而用过氧化氢制氧气,O则由-1价转化为0价,如生成1mol O2,需转移2mol电子,当制得同温同压下相同体积的氧气时,三个反应中转移的电子数之比为2:2:1,
故选:B.
点评 本题考查氧化还原反应的计算,题目难度不大,注意O元素在三种物质中的化合价的数值,为解答该题的关键.

练习册系列答案
 夺冠训练单元期末冲刺100分系列答案
夺冠训练单元期末冲刺100分系列答案 新思维小冠军100分作业本系列答案
新思维小冠军100分作业本系列答案 名师指导一卷通系列答案
名师指导一卷通系列答案
相关题目
7.下列化学实验事实及其解释或得出的结论都正确的是( )
| A. | 向SO2 水溶液中滴加盐酸酸化的BaCl2 溶液,有白色沉淀生成,说明BaSO4难溶于盐酸 | |
| B. | 向某溶液中加入稀盐酸,产生的气体通入澄清石灰水,石灰水变浑浊,该溶液一定是碳酸盐溶液 | |
| C. | 向0.1mol•L-1 FeSO4 溶液中滴加少量酸性KMnO4 溶液,紫红色KMnO4 溶液褪色,说明Fe2+具有还原性 | |
| D. | 向某溶液中滴加NaOH溶液,未产生使湿润的红色石蕊试纸变蓝的气体,该溶液中一定不含NH4+ |
4.下列有关物质的性质或用途的说法中,正确的是( )
①Si可用于制造光导纤维②明矾在水中能生成Al(OH)3胶体,可用作净水剂
③铁红常用作红色油漆和涂料④SiO2、Na2CO3和CaCO3可用于制玻璃
⑤水玻璃可用于生产防火材料 ⑥氯气具有漂白性,可以使有色布条褪色.
①Si可用于制造光导纤维②明矾在水中能生成Al(OH)3胶体,可用作净水剂
③铁红常用作红色油漆和涂料④SiO2、Na2CO3和CaCO3可用于制玻璃
⑤水玻璃可用于生产防火材料 ⑥氯气具有漂白性,可以使有色布条褪色.
| A. | ①②③⑤ | B. | ②④⑤⑥ | C. | ③④⑤⑥ | D. | ②③④⑤ |
11.加热蒸干下列盐溶液,可得到原溶质的是( )
| A. | FeCl3 | B. | Na2CO3 | C. | K2SO3 | D. | TiCl4 |
8.下列电子排布式或轨道表示式正确的是( )
| A. | C原子的轨道表示式: | |
| B. | N原子轨道表示式: | |
| C. | Cr基态原子核外电子排布式:[Ar]3d54s1 | |
| D. | Ca原子的电子排布式:[Ar]3d2 |
6.下列说法不正确的是( )
| A. | 乙烯能使酸性高锰酸钾溶液褪色,甲烷则不能使其褪色 | |
| B. | 溶于水能导电的化合物不一定是离子化合物 | |
| C. | 需要加热的反应不一定是吸热反应 | |
| D. | 石油的分馏和煤的干馏都是化学变化 |
 .反应I除生成两种正盐外,还有水生成,其化学方程式为COS+4NaOH=Na2S+Na2CO3+2H2O已知反应II的产物X的溶液中硫元素的主要存在形式为S2O32-,则II中主要反应的离子方程式为2S2-+5H2O=S2O32-+4H2↑+2OH-.
.反应I除生成两种正盐外,还有水生成,其化学方程式为COS+4NaOH=Na2S+Na2CO3+2H2O已知反应II的产物X的溶液中硫元素的主要存在形式为S2O32-,则II中主要反应的离子方程式为2S2-+5H2O=S2O32-+4H2↑+2OH-.