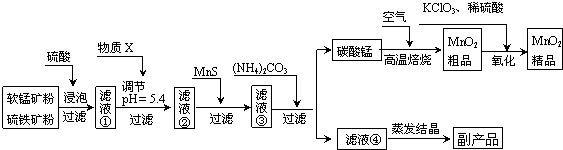
题目内容
有一氧化钠和过氧化钠的混合物7.0g,投入93.8g水中充分反应后,恰好得到溶液100g.求:
(1)原混合物中氧化钠的质量分数;
(2)反应后所得溶液中溶质的质量分数.
(1)原混合物中氧化钠的质量分数;
(2)反应后所得溶液中溶质的质量分数.
考点:有关混合物反应的计算
专题:计算题
分析:(1)反应前后质量变化是过氧化钠与水反应生成氧气引起的,根据方程式计算出过氧化钠的质量,再根据混合物总质量计算出原混合物中氧化钠的质量;
(2)根据钠原子守恒计算出溶质氢氧化钠的质量,再计算出氢氧化钠的质量分数.
(2)根据钠原子守恒计算出溶质氢氧化钠的质量,再计算出氢氧化钠的质量分数.
解答:
解:(1)发生的反应为:2Na2O2+2H2O═4NaOH+O2↑、Na2O+H2O═2NaOH,混合物投入水中,质量减少了:93.8g+7.0g-100g=0.8g,则反应生成氧气的质量为0.8g,氧气的物质的量为:
=0.025mol,
根据反应方程式可知,混合物中含有过氧化钠的物质的量为:n(Na2O2)=2n(O2)=0.05mol,
混合物中过氧化钠的质量为:78g/mol×0.05mol=3.9g,
所以原混合物中含有氧化钠的质量为:7.0g-3.9g=3.1g,氧化钠的质量分数为:
×100%≈44.3%,
答:原混合物中氧化钠的质量分数为44.3%;
(2)氧化钠的物质的量为:
=0.05mol,
根据钠原子守恒,完全反应后生成氢氧化钠的物质的量为:0.05mol×2+0.05mol×2=0.2mol,
反应后的溶液中氢氧化钠的质量分数为:
×100%=8%,
答:反应后所得溶液中溶质的质量分数为8%.
| 0.8g |
| 32g/mol |
根据反应方程式可知,混合物中含有过氧化钠的物质的量为:n(Na2O2)=2n(O2)=0.05mol,
混合物中过氧化钠的质量为:78g/mol×0.05mol=3.9g,
所以原混合物中含有氧化钠的质量为:7.0g-3.9g=3.1g,氧化钠的质量分数为:
| 3.1g |
| 7.0g |
答:原混合物中氧化钠的质量分数为44.3%;
(2)氧化钠的物质的量为:
| 3.1g |
| 62g/mol |
根据钠原子守恒,完全反应后生成氢氧化钠的物质的量为:0.05mol×2+0.05mol×2=0.2mol,
反应后的溶液中氢氧化钠的质量分数为:
| 40g/mol×0.2mol |
| 100g |
答:反应后所得溶液中溶质的质量分数为8%.
点评:本题考查了溶质质量分数的计算、混合物反应的计算,题目难度中等,注意掌握有关混合物反应的计算,明确反应原理为解答本题的关键.

练习册系列答案
相关题目
有关AgCl沉淀的溶解平衡的说法中,不正确的是( )
| A、AgCl沉淀的生成和溶解不断进行,但速率相等 |
| B、AgCl难溶于水,溶液中没有Ag+和Cl- |
| C、升高温度,AgCl沉淀的溶解度增大 |
| D、向AgCl沉淀中加入NaCl固体,AgCl沉淀的溶解度降低 |
下列实验操作、实验现象及解释与结论正确的是( )
| A、向某溶液中同时滴入几滴KSCN溶液和少量新制氯水 溶液变为红色 原溶液一定含有Fe2+ |
| B、向AgCl的饱和溶液中加入少量NaCl晶体 无明显现象 NaCl溶于水,阻止了AgCl的溶解 |
| C、相同温度下,测定等物质的量浓度的Na2CO3和Na2SiO3两溶液的pH 后者的pH大 碳的非金属性比硅强 |
| D、在溴水中加入少量某有机物,充分振荡、静置 溴水褪色 该有机物中含有碳碳双键 |


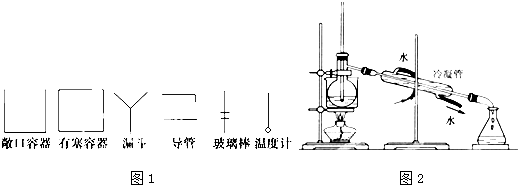
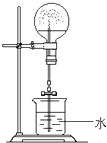 某课外小组同学拟用乙醇分解法制乙烯,并对该反应进行探究.
某课外小组同学拟用乙醇分解法制乙烯,并对该反应进行探究.