题目内容
下列实验操作、实验现象及解释与结论正确的是( )
| A、向某溶液中同时滴入几滴KSCN溶液和少量新制氯水 溶液变为红色 原溶液一定含有Fe2+ |
| B、向AgCl的饱和溶液中加入少量NaCl晶体 无明显现象 NaCl溶于水,阻止了AgCl的溶解 |
| C、相同温度下,测定等物质的量浓度的Na2CO3和Na2SiO3两溶液的pH 后者的pH大 碳的非金属性比硅强 |
| D、在溴水中加入少量某有机物,充分振荡、静置 溴水褪色 该有机物中含有碳碳双键 |
考点:化学实验方案的评价
专题:实验评价题
分析:A.原溶液中含有铁离子进行实验操作也能出现此现象;
B.根据氯化银沉淀溶解平衡移动分析;
C.酸越弱,对应盐的水解程度越大,利用最高价含氧酸的酸性比较非金属性的强弱;
D.向某有机物中加入少量溴水,充分振荡后观察到溴水褪色,可能发生萃取现象.
B.根据氯化银沉淀溶解平衡移动分析;
C.酸越弱,对应盐的水解程度越大,利用最高价含氧酸的酸性比较非金属性的强弱;
D.向某有机物中加入少量溴水,充分振荡后观察到溴水褪色,可能发生萃取现象.
解答:
解:A.向某溶液中加入几滴KSCN溶液,溶液不显红色.再向溶液中加入几滴新制的氯水,溶液变为红色,则该溶液中一定含有Fe2+,故A错误;
B.向AgCl的饱和溶液中加入少量NaCl晶体,氯离子浓度增大,有白色沉淀生成,故B错误;
C.相同温度下,测定等物质的量浓度的Na2CO3和Na2SiO3两溶液的pH 后者的pH大,则碳酸酸性大于硅酸,碳的非金属性比硅强,故C正确;
D.苯和四氯化碳都能萃取溴水中的溴而使溴水褪色,所以能使溴水褪色的有机物中不一定含有碳碳双键,故D错误.
故选C.
B.向AgCl的饱和溶液中加入少量NaCl晶体,氯离子浓度增大,有白色沉淀生成,故B错误;
C.相同温度下,测定等物质的量浓度的Na2CO3和Na2SiO3两溶液的pH 后者的pH大,则碳酸酸性大于硅酸,碳的非金属性比硅强,故C正确;
D.苯和四氯化碳都能萃取溴水中的溴而使溴水褪色,所以能使溴水褪色的有机物中不一定含有碳碳双键,故D错误.
故选C.
点评:本题考查较为综合,涉及物质检验、溶度积、盐类水解以及有机物的结构等知识,侧重于学生的分析能力和实验能力的考查,为高考常见题型,注意相关知识的学习与积累,难度不大.

练习册系列答案
 全能练考卷系列答案
全能练考卷系列答案 一课一练课时达标系列答案
一课一练课时达标系列答案
相关题目
设NA表示阿伏加德罗常数的值,下列说法正确的是( )
| A、78g Na2O2晶体中离子总数为4NA |
| B、常温下,2L、1 mol?L-1的乙酸溶液中,所含分子总数小于2NA |
| C、标准状况下,5.6L NO和5.6 L O2组成的混合气体中所含原子数为NA |
| D、对于反应:C2H2(g)+5/2O2(g)=2CO2(g)+H2O(l)△H=-1300 kJ/mol,有2NA个碳氧双键形成时,放出1300 kJ的热量 |
NA表示阿伏加德罗常数,下列叙述正确的是( )
| A、同温同压下,原子数均为NA的氢气和氦气具有相同的体积 |
| B、常温下,42g乙烯和环丙烷的混合气体中含有的碳原子数目为3NA |
| C、标准状况下,11.2L氯仿(三氯甲烷)中含有C-Cl键的数目为1.5 NA |
| D、在反应CaO+3C=CaC2+CO中,生成1 mol CO,转移的电子数为3NA |
 X、Y、Z、W有如图所示的转化关系,已知△H=△H1+△H2,则X、Y可能是
X、Y、Z、W有如图所示的转化关系,已知△H=△H1+△H2,则X、Y可能是①C、CO ②S、SO2③AlCl3、Al(OH)3 ④Na2CO3、NaHCO3( )
| A、①③④ | B、①②③ |
| C、①② | D、①②③④ |
在指定环境中,下列各组离子或分子可以大量共存的是( )
| A、常温下,pH<7的溶液中:SO32-、Cu2+、HClO、K+ |
| B、加入铝粉后产生大量氢气的溶液中:Fe3+、Na+、NO3-、SO42- |
| C、无色透明溶液中:[Ag(NH3)2]+、NH3?H2O、OH-、NO3- |
| D、常温下,水电离出的c(H+)=10-14 mol?L-1的溶液中:Na+、Ca2+、Br-、HCO3- |

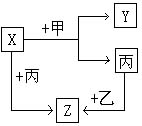 如图所示,甲、乙、丙、是三种常见单质,x、y、z是常见的三种化合物,它们之间有如下转化关系:
如图所示,甲、乙、丙、是三种常见单质,x、y、z是常见的三种化合物,它们之间有如下转化关系:

