题目内容
碘在医药、照相、橡胶、染料、气象等许多领域都具有广泛的用途,海洋中虽然含碘的浓度相当小,每升海水中平均含碘0.06mg,但海洋里碘的总储量仍很惊人--9.3×1010t,比陆地上要多得多.一般生长在海底的海带含碘0.3%~0.5%,有的可达1%,比海水中碘的浓度高出十几万倍!海藻中含有丰富的碘元素(以I-形式存在).实验室提取碘的流程如下:

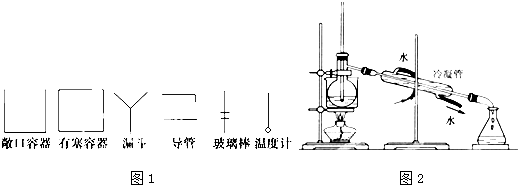
(1)在虚线框内画出实验操作①的仪器装置示意图.实验操作③的名称是 ,所用主要仪器名称为 .

说明:实验装置中仪器用下面方法表示.铁架台、连接胶管等不必画出,如需加热,在仪器下方用“△”表示.下列图1均为玻璃仪器,应标清液面或固体可视界面.
(2)提取碘的过程中,可供选择的有机试剂是 (填序号).
A.酒精(沸点78℃) B.四氯化碳(沸点77℃)
C.甘油(沸点290℃) D.苯(沸点80℃)
(3)在操作②中,溶液中生成少量ICl,为消耗此杂质,使碘全部游离出来,应加入适量 (填序号)溶液,反应的离子方程式为 .
A.KIO3 B.HClO C.KI D.Br2
(4)为使从含碘有机溶液中提取碘并回收溶剂,采用水浴加热蒸馏(如图2所示).请指出图中实验装置中错误之处(有处填几处,下列空白可不填满,也可补充).
① ,② ,③ ,④ .
(5)实验中使用水浴的原因是 ,最后晶体碘聚集在 (填仪器名称)中.

(1)在虚线框内画出实验操作①的仪器装置示意图.实验操作③的名称是

说明:实验装置中仪器用下面方法表示.铁架台、连接胶管等不必画出,如需加热,在仪器下方用“△”表示.下列图1均为玻璃仪器,应标清液面或固体可视界面.

(2)提取碘的过程中,可供选择的有机试剂是
A.酒精(沸点78℃) B.四氯化碳(沸点77℃)
C.甘油(沸点290℃) D.苯(沸点80℃)
(3)在操作②中,溶液中生成少量ICl,为消耗此杂质,使碘全部游离出来,应加入适量
A.KIO3 B.HClO C.KI D.Br2
(4)为使从含碘有机溶液中提取碘并回收溶剂,采用水浴加热蒸馏(如图2所示).请指出图中实验装置中错误之处(有处填几处,下列空白可不填满,也可补充).
①
(5)实验中使用水浴的原因是
考点:海带成分中碘的检验
专题:
分析:(1)分离固体和液体用过滤,②利用溶解性的差异判断操作方法并选择仪器;
(2)萃取的基本原则两种溶剂互不相溶,且溶质在一种溶剂中的溶解度比在另一种大的多.
(3)依据ICl→I2实现该转化,应该加入还原剂,且不引进杂质离子来回答;
(4)冷凝水应是下进上出,温度计水银球应与烧瓶支管口相平,烧杯受热要垫石棉网;
(5)水浴加热的温度是使试管内或烧杯内试剂受热温度均匀,具有长时间加热温度保持恒定的特点.
(2)萃取的基本原则两种溶剂互不相溶,且溶质在一种溶剂中的溶解度比在另一种大的多.
(3)依据ICl→I2实现该转化,应该加入还原剂,且不引进杂质离子来回答;
(4)冷凝水应是下进上出,温度计水银球应与烧瓶支管口相平,烧杯受热要垫石棉网;
(5)水浴加热的温度是使试管内或烧杯内试剂受热温度均匀,具有长时间加热温度保持恒定的特点.
解答:
解:(1)分离固体和液体用过滤,实验操作①是过滤,装置如下: ,③将碘水中的碘单质萃取出来,选择合适的萃取剂,进行萃取分液即可,要使用分液漏斗,故答案为:
,③将碘水中的碘单质萃取出来,选择合适的萃取剂,进行萃取分液即可,要使用分液漏斗,故答案为: ;萃取分液;分液漏斗;
;萃取分液;分液漏斗;
(2)萃取的基本原则两种溶剂互不相溶,且溶质在一种溶剂中的溶解度比在另一种大的多,从题给信息可知,酒精、甘油和水互溶,不能用作萃取剂,苯、四氯化碳与水互不相容,故可用,故答案为:BD;
(3)要实现转化ICl→I2,应该加入还原剂,且不引进杂质离子,可以选择还原性较强的碘离子,发生离子反应为ICl+I-═Cl-+I2,故答案为:C;ICl+I-═Cl-+I2;
(4)烧杯受热要垫石棉网,增大受热面积;冷凝水应是下进上出,冷凝水的方向错误,应为下进上出;温度计水银球的位置错误,温度计水银球应与烧瓶支管口相平;
故答案为:缺石棉网;温度计插到了液体中;冷凝管进出水方向颠倒;
(5)水浴加热的温度是使试管内或烧杯内试剂受热温度均匀,具有长时间加热温度保持恒定的特点,四氯化碳沸点:76.8℃,碘单质沸点为184℃,所以最后晶态碘在蒸馏烧瓶里聚集,
故答案为:有机溶剂沸点较低,水浴加热可控制温度不致过高,避免碘蒸气进入冷凝管,且可使蒸馏烧瓶受热均匀;蒸馏烧瓶.
 ,③将碘水中的碘单质萃取出来,选择合适的萃取剂,进行萃取分液即可,要使用分液漏斗,故答案为:
,③将碘水中的碘单质萃取出来,选择合适的萃取剂,进行萃取分液即可,要使用分液漏斗,故答案为: ;萃取分液;分液漏斗;
;萃取分液;分液漏斗;(2)萃取的基本原则两种溶剂互不相溶,且溶质在一种溶剂中的溶解度比在另一种大的多,从题给信息可知,酒精、甘油和水互溶,不能用作萃取剂,苯、四氯化碳与水互不相容,故可用,故答案为:BD;
(3)要实现转化ICl→I2,应该加入还原剂,且不引进杂质离子,可以选择还原性较强的碘离子,发生离子反应为ICl+I-═Cl-+I2,故答案为:C;ICl+I-═Cl-+I2;
(4)烧杯受热要垫石棉网,增大受热面积;冷凝水应是下进上出,冷凝水的方向错误,应为下进上出;温度计水银球的位置错误,温度计水银球应与烧瓶支管口相平;
故答案为:缺石棉网;温度计插到了液体中;冷凝管进出水方向颠倒;
(5)水浴加热的温度是使试管内或烧杯内试剂受热温度均匀,具有长时间加热温度保持恒定的特点,四氯化碳沸点:76.8℃,碘单质沸点为184℃,所以最后晶态碘在蒸馏烧瓶里聚集,
故答案为:有机溶剂沸点较低,水浴加热可控制温度不致过高,避免碘蒸气进入冷凝管,且可使蒸馏烧瓶受热均匀;蒸馏烧瓶.
点评:本题考查了物质的分离和提纯,掌握过滤、萃取、蒸馏等操作是解答本题的关键,题目难度不大.

练习册系列答案
相关题目
向盛有AgNO3溶液的试管中滴入少量NaCl溶液,加入氨水至过量,下列关于实验现象的叙述正确的是( )
| A、生成白色沉淀,加氨水后沉淀溶解,反应前后Ag+的浓度不变 |
| B、生成白色沉淀,加入氨水后沉淀转化成AgOH |
| C、生成白色沉淀,加入氨水后生成了更难溶的配合物Ag(NH3)2Cl? |
| D、向AgNO3溶液中直接滴加氨水,产生的现象与上述相同 |
提纯含有少量硫酸钾和硝酸钙杂质的硝酸钾溶液,可以使用的方法为( )
| A、依次加入过量硝酸钡和碳酸钾溶液,过滤,除去沉淀,溶液中补加适量硝酸 |
| B、依次加入过量碳酸钾和硝酸钡溶液,过滤,出去沉淀,溶液中补加适量硝酸 |
| C、依次加入过量硝酸钡和碳酸钾溶液,溶液中补加适量硝酸 |
| D、加入过量碳酸钾溶液,过滤,出去沉淀,溶液中补加适量硝酸 |
用NA表示阿伏伽德罗常数,下列说法正确的是( )
| A、32g O2所含分子数为2NA |
| B、28g N2所含质子数为2NA |
| C、NA个CO分子和0.5mol CH4的质量之比为7:4 |
| D、14g N2中含有7NA个电子 |
NA表示阿伏加德罗常数,下列叙述正确的是( )
| A、同温同压下,原子数均为NA的氢气和氦气具有相同的体积 |
| B、常温下,42g乙烯和环丙烷的混合气体中含有的碳原子数目为3NA |
| C、标准状况下,11.2L氯仿(三氯甲烷)中含有C-Cl键的数目为1.5 NA |
| D、在反应CaO+3C=CaC2+CO中,生成1 mol CO,转移的电子数为3NA |
 海洋植物如海带、海藻中含有丰富的碘元素,碘元素以碘离子的形式存在.实验室里从海藻中提取碘的流程如下:
海洋植物如海带、海藻中含有丰富的碘元素,碘元素以碘离子的形式存在.实验室里从海藻中提取碘的流程如下:
 某学校化学兴趣小组设计实验来探究“外界条件对化学反应速率的影响”.
某学校化学兴趣小组设计实验来探究“外界条件对化学反应速率的影响”.