题目内容
11.(1)将NaClO和NH3按物质的量之比为1:2反应,可生产火箭发动机的一种优质燃料肼(N2H4),试写出反应的化学方程式:2NH3+NaClO=N2H4+NaCl+H2O,反应中N2H4是氧化产物.(2)发射火箭时若以肼作燃料,一氧化二氮(N2O)作氧化剂,两者反应生成对大气无污染、可参与大气循环的物质,写出反应的化学方程式:N2H4+2N2O$\frac{\underline{\;催化剂\;}}{\;}$3N2+2H2O.
(3)N(NO2)3是科学家2011年发现的一种新型火箭推进剂的原料.下列有关说法正确的是CD.
A.该物质只具有氧化性
B.该物质的摩尔质量是152
C.15.2g该物质含有6.02×1023个原子
D.该物质既有氧化性又有还原性.
分析 (1)NaClO和NH3按物质的量之比为1:2,则NH3和NaClO的计量数2:1,然后根据原子守恒分析;
(2)根据题给信息,结合氧化还原反应原理知肼与一氧化氮反应生成的产物为水和氮气;
(3)A.该物质N是+3价中间价态,既有氧化性,又有还原性;
B.该物质的摩尔质量是152g/mol;
C.15.2g该物质的物质的量为0.1mol,含有0.1×10×6.02×1023个原子
D.该物质N是+3价中间价态,该物质既有氧化性又有还原性.
解答 解:(1)NaClO和NH3按物质的量之比为1:2,则NH3和NaClO的计量数2:1,结合原子守恒可知反应为2NH3+NaClO=N2H4+NaCl+H2O,Cl元素的化合价降低,则NaClO为氧化剂,氧化产物为:N2H4,故答案为:2NH3+NaClO=N2H4+NaCl+H2O;N2H4;
(2)根据题给信息,结合氧化还原反应原理知肼与一氧化氮反应生成的产物为水和氮气.N2H4中N从-2价升高到氮气中的0价,N2O从+1价降低到氮气中的0价,所以N2H4和N2O的计量数为1和2,发生的反应的化学方程式为N2H4+2N2O$\frac{\underline{\;催化剂\;}}{\;}$3N2+2H2O,故答案为:N2H4+2N2O$\frac{\underline{\;催化剂\;}}{\;}$3N2+2H2O;
(3)A.该物质N是+3价中间价态,既有氧化性,又有还原性,故错误;
B.该物质的摩尔质量是152g/mol,故错误;
C.15.2g该物质的物质的量为0.1mol,含有0.1×10×6.02×1023个原子,故正确;
D.该物质N是+3价中间价态,该物质既有氧化性又有还原性,故正确;故选:CD.
点评 本题考查氧化还原反应,为高频考点,把握反应中元素的化合价变化为解答的关键,侧化学反应的书写的考查,综合性较强,题目难度不大.

| A. | 萃取、蒸发、分液 | B. | 分液、蒸馏、萃取 | C. | 分液、萃取、蒸馏 | D. | 蒸馏、萃取、分液 |
| A. | 离子半径顺序为X>Y | |
| B. | X、Y形成的化合物含共价键和离子键 | |
| C. | XY2分子中所有原子最外层均达到8电子稳定结构 | |
| D. | Y单质与氢气的混合气体光照条件下容易发生爆炸 |
| A. | 在常温常压下,2.24L SO2与O2混合气体中所含氧原子数为0.2NA | |
| B. | 标准状况下,20g D2O分子中所含中子数为10NA | |
| C. | 氢氧燃料电池正极消耗22.4L(标准状况)气体时,电路中通过的电子数目为2NA | |
| D. | 50mL 12mol•L-1盐酸与足量MnO2共热,转移的电子数为0.3NA |
| A. | Mg2+ Na+ OH- | B. | Al3+ NO3- Cl- | ||
| C. | K+ H+ HCO3- | D. | Mg2+ Ca2+ SO42- |
①含有相同数目的原子;②含有相同物质的量的质子;③属于同种元素;④具有相同的质量;⑤中子数相等;⑥电子数相等;⑦与氧气完全反应生成CO2时,消耗氧气的量相同;⑧几乎相同的化学性质.
| A. | 只有②③⑤ | B. | 只有 ①②③ | C. | 除④、⑤外均正确 | D. | 全部正确 |
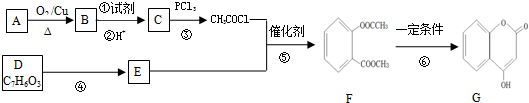
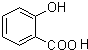 、
、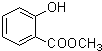 .
.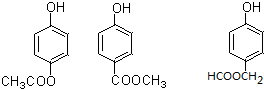 (写出一种即可).
(写出一种即可).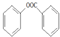 )是一种重要的有机合成中间体,参照化合物G的上述合成路线,设计一条以苯酚和甲苯为起始原料制备苯甲酸苯酚酯的合成路线
)是一种重要的有机合成中间体,参照化合物G的上述合成路线,设计一条以苯酚和甲苯为起始原料制备苯甲酸苯酚酯的合成路线 .
.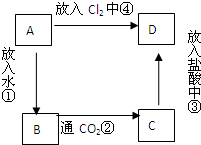 物质A是由A元素组成的单质,将其在酒精灯火焰上灼烧,火焰为黄色,B,C,D是含有A元素的三种不同化合物,A、B、C、D按图关系进行转化:
物质A是由A元素组成的单质,将其在酒精灯火焰上灼烧,火焰为黄色,B,C,D是含有A元素的三种不同化合物,A、B、C、D按图关系进行转化: