题目内容
20.关于等物质的量的12C和14C的叙述中正确的是( )①含有相同数目的原子;②含有相同物质的量的质子;③属于同种元素;④具有相同的质量;⑤中子数相等;⑥电子数相等;⑦与氧气完全反应生成CO2时,消耗氧气的量相同;⑧几乎相同的化学性质.
| A. | 只有②③⑤ | B. | 只有 ①②③ | C. | 除④、⑤外均正确 | D. | 全部正确 |
分析 等物质的量的612C原子和614C原子,则原子数相同,质子数相同,电子数相同,质子数决定元素的种类,则属于同种元素,由中子数=质量数-质子数可知,中子数不等,等物质的量的C消耗的氧气相同,同位素的化学性质相同,物理性质不同.
解答 解:①等物质的量的612C原子和614C原子,则原子数相同,故①正确;
②在原子中质子数均为6,则含有相同物质的量的质子,故②正确;
③质子数决定元素的种类,则属于同种元素,故③正确;
④因质量数分别为12、14,则等物质的量时二者的质量不同,故④错误;
⑤由中子数=质量数-质子数可知,中子数分别为6、8,则等物质的量时中子数不相等,故⑤错误;
⑥因质子数等于电子数,由②可知,电子数相等,故⑥正确;
⑦C的物质的量相等,则完全燃烧消耗氧气的质量相等,故⑦正确;
⑧同位素的化学性质相同,物理性质不同,则两种原子具有几乎相同的化学性质,故⑧正确;
故选C.
点评 本题考查原子的构成、原子中的数量关系、原子的化学性质等,较简单,明确质子数、电子数、中子数、质量数的关系即可解答.

练习册系列答案
 名牌学校分层周周测系列答案
名牌学校分层周周测系列答案 黄冈海淀全程培优测试卷系列答案
黄冈海淀全程培优测试卷系列答案
相关题目
8.下列关于金属及其化合物用途错误的是( )
| A. | Al2O3用来制造耐高温的实验仪器 | |
| B. | Fe2O3常用作油漆和涂料 | |
| C. | 过氧化钠可以用作供氧剂、漂白剂等 | |
| D. | 熟石灰常直接用来治疗胃酸过多 |
15.下列有关化学与环境保护的说法正确的是( )
| A. | 就地在田间焚烧秸秆,减少运输成本 | |
| B. | 烧煤进行脱硫、脱硝处理,减少空气污染 | |
| C. | 推广和鼓励多使用私家车出行 | |
| D. | 做好空气质量预报工作,以使污染程度高是好预防 |
5.H2与ICl的反应分①、②两步进行,其能量曲线如下图所示,下列有关说法错误的是( )
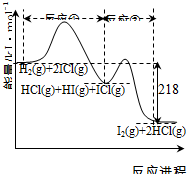

| A. | 反应①、反应②均为放热反应 | |
| B. | 反应①、反应②均为氧化还原反应 | |
| C. | 反应①比反应②的速率慢,与相应正反应的活化能无关 | |
| D. | 反应①、反应②的焓变之和为△H=-218kJ•mol-1 |
9.下列关于硅的说法中错误的是( )
| A. | 粗硅是由焦炭和二氧化硅在电炉中反应制得 | |
| B. | 硅的化学性质不活泼,常温下只与F2、HF、强碱反应 | |
| C. | 单质硅的主要用途为制造半导体材料和硅合金的原料 | |
| D. | SiO2制成的玻璃纤维,由于电能力强而被用于制造光缆 |
19.就有关物质的分离回答下面的问题
(1)现有一瓶A和B的混合液,已知它们的性质如下表.
据此分析,将A和B相互分离的常用方法是:分馏(蒸馏)
(2)在分液漏斗中用一种有机溶剂萃取水溶液里的某物质时,静置分层后,如果不知道哪一层液体是“水层”,试设计一种简便的判断方法.答:向分液漏斗中加入少量水,体积增大的液层是水层.
(1)现有一瓶A和B的混合液,已知它们的性质如下表.
物质 | 熔点/℃ | 沸点/℃ | 密度/g•cm-3 | 溶解性 |
A | -11.5 | 198 | 1.11 | A、B互溶,且均易溶于水 |
B | 17.9 | 290 | 1.26 |
(2)在分液漏斗中用一种有机溶剂萃取水溶液里的某物质时,静置分层后,如果不知道哪一层液体是“水层”,试设计一种简便的判断方法.答:向分液漏斗中加入少量水,体积增大的液层是水层.
 有机物F (C9H10O2) 是一种有茉莉花香味的酯.用下图所示的方法可以合成F.其中A是相对分子质量为28的烃,其产量常作为衡量石油化工发展水平的标志.E是只含碳、氢、氧的芳香族化合物,且苯环上只有一个侧链.
有机物F (C9H10O2) 是一种有茉莉花香味的酯.用下图所示的方法可以合成F.其中A是相对分子质量为28的烃,其产量常作为衡量石油化工发展水平的标志.E是只含碳、氢、氧的芳香族化合物,且苯环上只有一个侧链. .
. .
.