题目内容
19.X、Y为短周期元素,X原子各电子层的电子数的比值为1:4:1,它比Y原子少5个电子.下列叙述正确的是( )| A. | 离子半径顺序为X>Y | |
| B. | X、Y形成的化合物含共价键和离子键 | |
| C. | XY2分子中所有原子最外层均达到8电子稳定结构 | |
| D. | Y单质与氢气的混合气体光照条件下容易发生爆炸 |
分析 由X原子各电子层的电子数比为1:4:1,可知X原子核外有3个电子层,由电子排布规律可知,K层最多不超过2个电子且排满后才能排L层,故各层电子数为2、8、2,所以X为Mg元素,它比Y原子少5个电子,则Y的核外电子数为17,故Y为Cl元素,根据Mg和Cl元素对应单质及化合物的性质解答该题.
解答 解:A、氯离子的半径大于镁离子,故A错误;
B、氯化镁只含有离子键,不含共价键,故B错误;
C、氯化镁为离子晶体,不存在分子,故C错误;
D、氯气与氢气的混合气体光照条件下容易发生爆炸,故D正确;
故选D.
点评 本题考查原子结构和元素周期律的关系,题目难度不大,注意掌握核外电子排布规律推断元素.

练习册系列答案
相关题目
9.下列关于相同物质的量的Na2CO3和NaHCO3的比较中,正确的是( )
| A. | 相同温度下,在水中的溶解度:Na2CO3<NaHCO3 | |
| B. | 热稳定性:Na2CO3<NaHCO3 | |
| C. | 都能与足量盐酸反应放出CO2,且产生气体的物质的量相同 | |
| D. | 与相同浓度的盐酸反应放出CO2的速率Na2CO3大于NaHCO3 |
7. 已知:2HI+Cl2═2HCl+I2,I2为固体.常温常压下,两个容积相同的烧瓶中分别盛满X和Y两种气体,打开开关a,两烧瓶内的气体充分混合后,容器内的压强由大到小的顺序正确的是( )
已知:2HI+Cl2═2HCl+I2,I2为固体.常温常压下,两个容积相同的烧瓶中分别盛满X和Y两种气体,打开开关a,两烧瓶内的气体充分混合后,容器内的压强由大到小的顺序正确的是( )
 已知:2HI+Cl2═2HCl+I2,I2为固体.常温常压下,两个容积相同的烧瓶中分别盛满X和Y两种气体,打开开关a,两烧瓶内的气体充分混合后,容器内的压强由大到小的顺序正确的是( )
已知:2HI+Cl2═2HCl+I2,I2为固体.常温常压下,两个容积相同的烧瓶中分别盛满X和Y两种气体,打开开关a,两烧瓶内的气体充分混合后,容器内的压强由大到小的顺序正确的是( )| 编号 | ① | ② | ③ | ④ |
| 气体X | HI | NH3 | H2 | SO2 |
| 气体Y | Cl2 | HCl | Cl2 | H2S |
| A. | ②>③>①>④ | B. | ③>①=④>② | C. | ③>①>④>② | D. | ④>①>②>③ |
4.下列关于化学反应速率的说法中,正确的是( )
| A. | 升高温度,活化分子的百分数不一定增大,但是化学反应速率一定增大 | |
| B. | 在化学反应前后催化剂的化学性质不变,但是由于参与化学反应导致质量减小 | |
| C. | 使用正催化剂,能降低化学反应的活化能,增大活化分子的百分数,化学反应速率一定增大 | |
| D. | 活化分子发生碰撞即可发生化学反应 |
8.下列关于金属及其化合物用途错误的是( )
| A. | Al2O3用来制造耐高温的实验仪器 | |
| B. | Fe2O3常用作油漆和涂料 | |
| C. | 过氧化钠可以用作供氧剂、漂白剂等 | |
| D. | 熟石灰常直接用来治疗胃酸过多 |
9.下列关于硅的说法中错误的是( )
| A. | 粗硅是由焦炭和二氧化硅在电炉中反应制得 | |
| B. | 硅的化学性质不活泼,常温下只与F2、HF、强碱反应 | |
| C. | 单质硅的主要用途为制造半导体材料和硅合金的原料 | |
| D. | SiO2制成的玻璃纤维,由于电能力强而被用于制造光缆 |
 有机物F (C9H10O2) 是一种有茉莉花香味的酯.用下图所示的方法可以合成F.其中A是相对分子质量为28的烃,其产量常作为衡量石油化工发展水平的标志.E是只含碳、氢、氧的芳香族化合物,且苯环上只有一个侧链.
有机物F (C9H10O2) 是一种有茉莉花香味的酯.用下图所示的方法可以合成F.其中A是相对分子质量为28的烃,其产量常作为衡量石油化工发展水平的标志.E是只含碳、氢、氧的芳香族化合物,且苯环上只有一个侧链. .
. .
.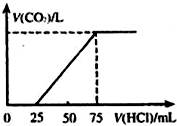 有10mL NaOH溶液,向其中通入一定量的CO2,得到了Na2CO3和NaHCO3的混合溶液.向所得溶液中逐滴加入0.1mol/L的盐酸,边加边振荡,使其充分反应,产生CO2气体的体积(标准状况)与所加盐酸体积之间的关系如图所示.
有10mL NaOH溶液,向其中通入一定量的CO2,得到了Na2CO3和NaHCO3的混合溶液.向所得溶液中逐滴加入0.1mol/L的盐酸,边加边振荡,使其充分反应,产生CO2气体的体积(标准状况)与所加盐酸体积之间的关系如图所示.