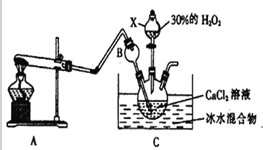
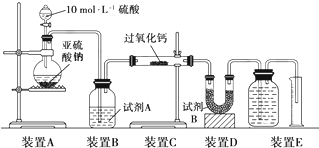
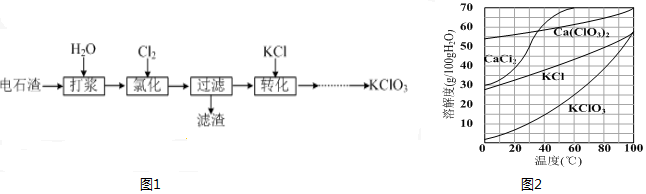
题目内容
5.明矾石经处理后得到明矾[KAl(SO4)2•12H2O].从明矾制备Al、K2SO4和H2SO4的工艺过程如下所示: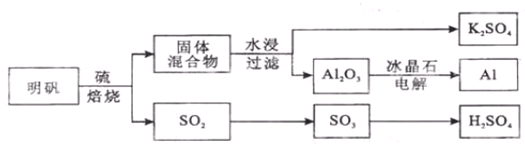
焙烧明矾的化学方程式为:4KAl(SO4)2•12H2O+3S═2K2SO4+2Al2O3+9SO2+48H2O
(1)在焙烧明矾的反应中,还原剂是S;当有3mol S参与反应时转移电子数为12mol
(2)从水浸后的滤液中得到K2SO4晶体的步骤是蒸发浓缩、冷却结晶、过滤、洗涤、干燥.
(3)焙烧中产生的SO2检验试剂可以用品红溶液.
(4)写出电解Al2O3的化学方程式为2Al2O3$\frac{\underline{\;通电\;}}{\;}$4Al+3O2↑.
(5)焙烧948t明矾(M=474g/mol),若SO2 的利用率为96%,可生产质量分数为98%的硫酸432t.
分析 明矾和硫焙烧发生4KAl(SO4)2•12H2O+3S=2K2SO4+2Al2O3+9SO2↑+48H2O,生成的二氧化硫可用品红检验,气体二氧化硫与氧气生成三氧化硫,三氧化硫用水吸收生成硫酸,SO3+H2O=H2SO4,制得硫酸;焙烧所得固体混合物(Al2O3、K2SO4),用水浸,硫酸钾溶解,氧化铝不溶,过滤,从水浸后的滤液中蒸发结晶得到K2SO4晶体,步骤③电解Al2O3,制得Al,
根据原子守恒计算生成的硫酸,以此解答该题.
解答 解:(1)明矾和硫焙烧发生4KAl(SO4)2•12H2O+3S=2K2SO4+2Al2O3+9SO2↑+48H2O,反应中S被氧化生成二氧化硫,故还原剂为S;由方程式可知当有3mol S参与反应时转移电子数为12mol;
故答案为:S;12;
(2)从硫酸钾溶液中获得晶体,需要经过蒸发浓缩、冷却结晶、过滤、洗涤、干燥等操作;
故答案为:蒸发浓缩、冷却结晶、过滤、洗涤、干燥;
(3)二氧化硫的溶液有漂白性,故可选用品红溶液检验二氧化硫;
故答案为:品红溶液;
(4)氧化铝电解生成Al和氧气,化学方程式为:2Al2O3$\frac{\underline{\;通电\;}}{\;}$4Al+3O2↑;
故答案为:2Al2O3$\frac{\underline{\;通电\;}}{\;}$4Al+3O2↑;
(5)明矾的物质的量=$\frac{948×1{0}^{6}g}{474g/mol}$=2×106mol,根据方程式知,生成二氧化硫的物质的量=$\frac{2×1{0}^{6}mol}{4}$=4.5×106mol,SO2的利用率为96%,根据硫原子守恒知,硫酸的物质的量=二氧化硫的物质的量=4.32×106mol,则98%的质量=$\frac{4.32×1{0}^{6}mol×98g/mol}{98%}$=4.32×106g=432t;
故答案为:432.
点评 本题考查物质的制备,为高考常见题型,题目难度中等,试题有利于培养学生的逻辑推理能力,提高学生灵活运用基础知识解决实际问题的能力及实验能力.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案| A. | 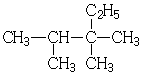 2,3-二甲基-3-乙基丁烷 | B. | 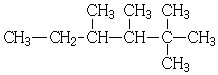 2,2,3,4-四甲基己烷 | ||
| C. |  对二甲苯 | D. |  2,4,4-三甲基戊烯 |
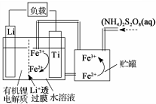
| A. | Li+透过膜除允许Li+通过外,还允许H2O分子通过 | |
| B. | 放电时,进入贮罐的液体发生:S2O82-+2Fe2+=2Fe3++2SO42- | |
| C. | 充电时,钛电极与外电源的负极相连 | |
| D. | 充电时,电池内部发生的总反应为Li++Fe3+=Li+Fe2+ |
| A. | 4种 | B. | 7种 | C. | 8种 | D. | 9种 |
| A. | 原子半径:Y>X | B. | 原子序数:Y>X | ||
| C. | 电子层数:Y>X | D. | 最外层电子数:Y>X |