题目内容
15.以电石渣[主要成分为Ca(OH)2和CaCO3]为原料制备KClO3的流程如图1: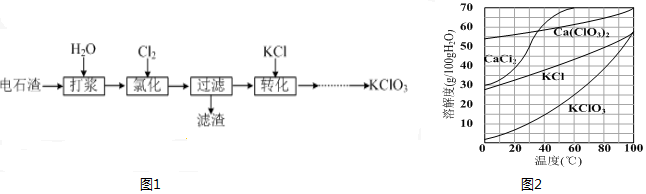
(4)氯化过程控制电石渣过量,在75℃左右进行.氯化时存在Cl2与Ca(OH)2作用生成Ca(ClO)2的反应,Ca(ClO)2进一步转化为Ca(ClO3)2,少量Ca(ClO)2 分解为CaCl2和O2.
提高Cl2转化为Ca(ClO3)2的转化率的可行措施有AB(填序号).
A.适当减缓通入Cl2速率 B.充分搅拌浆料 C.加水使Ca(OH)2完全溶解
(5)氯化过程中Cl2 转化为Ca(ClO3)2的总反应方程式为6Ca(OH)2+6Cl2═Ca(ClO3)2+5CaCl2+6H2O
氯化完成后过滤.滤渣的主要成分为CaCO3、Ca(OH)2(填化学式).
(6)向滤液中加入稍过量KCl固体可将Ca(ClO3)2转化为KClO3,若溶液中KClO3的含量为100g?L-1,从该溶液中尽可能多地析出KClO3固体的方法是蒸发浓缩、冷却结晶.
(7)工业上常用磷精矿[Ca5(PO4)3F]和硫酸反应制备磷酸.已知25℃,101kPa时(如图2):
CaO(s)+H2SO4(l)=CaSO4(s)+H2O(l)△H=-271kJ/mol
5CaO(s)+H3PO4(l)+HF(g)=Ca5(PO4)3F (s)+5H2O(l)△H=-937kJ/mol
则Ca5(PO4)3F和硫酸反应生成磷酸的热化学方程式是Ca5(PO4)3F (s)+5H2SO4(l)=5CaSO4(s)+3H3PO4(l)+HF(g)△H=-418kJ/mol.
分析 电石渣含有Ca(OH)2,加入水打浆,通入氯气,可生成Ca(ClO)2,Ca(ClO)2进一步转化为Ca(ClO3)2,过滤后在滤液中加入KCl转化生成KClO3,经蒸发浓缩、冷却结晶可得晶体KClO3.
(4)提高Cl2转化为Ca(ClO3)2的转化率,可使氯气和氢氧化钙充分接触;
(5)发生6Ca(OH)2+6Cl2═Ca(ClO3)2+5CaCl2+6H2O,生成的Ca(ClO3)2溶于水,CaCO3不溶于水,Ca(OH)2微溶;
(6)经蒸发浓缩、冷却结晶可得晶体KClO3;
(7)①CaO(s)+H2SO4(l)═CaSO4(s)+H2O(l)△H=-271kJ/mol;②5CaO(s)+3H3PO4(l)+HF(g)═Ca5(PO4)3F(s)+5H2O(l)△H=-937kJ/mol
根据盖斯定律:①×5-②得Ca5(PO4)3F和硫酸反应生成磷酸的热化学方程式.
解答 解:(4)提高Cl2转化为Ca(ClO3)2的转化率,可使氯气和氢氧化钙充分接触,可适当减缓通入Cl2速率、充分搅拌浆料,因氢氧化钙微溶于水,加水溶解的做法不可取,因浓度过低,对后续实验不利,
故答案为:AB;
(5)发生6Ca(OH)2+6Cl2═Ca(ClO3)2+5CaCl2+6H2O,生成的Ca(ClO3)2溶于水,CaCO3不溶于水,Ca(OH)2微溶,则滤渣中含有CaCO3、Ca(OH)2,
故答案为:CaCO3、Ca(OH)2;
(6)该溶液中尽可能多地析出KClO3固体,应经蒸发浓缩、冷却结晶,故答案为:蒸发浓缩、冷却结晶;
(7)已知25℃,101kPa时:
①CaO(s)+H2SO4(l)═CaSO4(s)+H2O(l)△H=-271kJ/mol
②5CaO(s)+3H3PO4(l)+HF(g)═Ca5(PO4)3F(s)+5H2O(l)△H=-937kJ/mol
根据盖斯定律:①×5-②得Ca5(PO4)3F和硫酸反应生成磷酸的热化学方程式是Ca5(PO4)3F (s)+5H2SO4(l)=5CaSO4(s)+3H3PO4(l)+HF(g)△H=-418kJ/mol,
故答案为:Ca5(PO4)3F (s)+5H2SO4(l)=5CaSO4(s)+3H3PO4(l)+HF(g)△H=-418kJ/mol.
点评 本题考查物质的制备,为高考常见题型和高频考点,侧重于学生的分析、实验能力的考查,解答本题注意把握物质的性质以及题给信息,把握反应的流程,同时要具有扎实的实验基础知识,难度中等.

 口算题天天练系列答案
口算题天天练系列答案| A. | 胆矾 玻璃 | B. | 汽油 液氯 | C. | 石油 盐酸 | D. | 干冰 铝热剂 |
| A. | 2,2-二甲基-3-丁烯 | B. | 2,2-二甲基-1-丁烯 | ||
| C. | 3,3-二甲基-1-丁烯 | D. | 3,3-二甲基-2-丁烯 |
| A. | 由水电离出H+的浓度c(H+):①>③ | |
| B. | 将等体积的④、⑤分别加蒸馏水稀释至pH=6,加入水的体积:④>⑤ | |
| C. | ①与③混合,若溶液pH=7,则体积:V(NaOH)>V(CH3COOH) | |
| D. | 将②与④等体积混合,得到的溶液pH>7 |
| A. | d1=d2 | B. | d1>d2 | C. | d1<d2 | D. | 无法确定 |
| A. | 焰火的五彩缤纷是某些金属元素物理性质的展现 | |
| B. | 侯氏制碱法的工艺流程应用了物质溶解度的差异 | |
| C. | 高纯度的硅广泛用于制作光导纤维,其遇强碱会“断路” | |
| D. | 家庭用洁厕灵与“84 消内液”不能同时使用 |
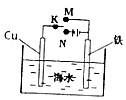
| A. | 电泳现象可证明胶体带电 | |
| B. | 如图装置,无论电键K接M还是接N,铁都能得到保护 | |
| C. | Fe与稀硝酸反应,当n(Fe):n(HNO3)=1:2时,Fe+NO3-+4H+═Fe3++NO↑+2H2O | |
| D. | 由反应2Fe2++Br2═2Fe3++2Br-可知,将1molCl2通入含1molFeBr2的溶液中能发生反应的离子方程为;2Cl2+2Fe2++2Br-═2Fe3++Br2+4Cl- |

 (填写电子式).
(填写电子式).