题目内容
1. 甲醇是新型的汽车动力燃料.工业上可通过CO和H2化合制备甲醇,该反应的热化学方程式为:CO (g)+2H2(g)?CH3OH (g)△H1=-116kJ•mol-1
甲醇是新型的汽车动力燃料.工业上可通过CO和H2化合制备甲醇,该反应的热化学方程式为:CO (g)+2H2(g)?CH3OH (g)△H1=-116kJ•mol-1(1)下列措施中有利于提高反应速率的是CD(双选,填字母).
A.降低温度 B.减小压强 C.通入CO D.加入催化剂
(2)已知:CO(g)+$\frac{1}{2}$O2(g)═CO2(g)△H2=-283kJ•mol-1
H2(g)+$\frac{1}{2}$O2(g)═H2O(g)△H3=-242kJ•mol-1
写出1mol甲醇燃烧生成CO2和水蒸气的热化学方程式CH3OH(g)+$\frac{3}{2}$O2(g)=CO2(g)+2H2O(g)△H=-651kJ•mol-1
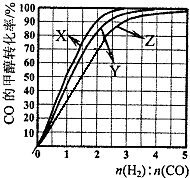
(3)为研究合成气最合适的起始组成比,在1L容器中,分别在230℃、250℃和270℃下,改变CO和 H2的起始组成比(设起始时CO的物质的量为1mol ),结果如图所示:
①230℃的实验结果所对应的曲线是X(填字母).
②从图中可以得出的结论是温度越高,CO的转化率越低或n(H2):n(CO)越低,CO的转化率越大.(写一条)
③在270℃时,当CO的转化率为50%时,计算反应CO (g)+2H2(g)?CH3OH (g)的平衡常数(要求列出化学反应方程式,写出计算过程,结果保留2位有效数字)
分析 (1)提高反应速率可增大浓度、压强、温度或加入催化剂;
(2)利用盖斯定律计算反应热;
(3)①正反应放热,则升高温度CO的转化率降低;
②由图可知,温度越高,CO的转化率越低,CO和 H2的起始组成比越小,CO的转化率越大;
③计算出平衡时各物质的浓度,结合K=$\frac{c(C{H}_{3}OH)}{c(CO)•{c}^{2}({H}_{2})}$计算.
解答 解:(1)提高反应速率可增大浓度、压强、温度或加入催化剂,则C、D正确,而降低温度、减小压强可减小反应速率,故答案为:CD;
(2))根据反应①CO(g)+2H2(g)?CH3OH(g);△H1=-116kJ•mol-1,
②CO(g)+$\frac{1}{2}$O2(g)═CO2(g)△H2=-283kJ•mol-1,
③H2(g)+$\frac{1}{2}$O2(g)═H2O(g)△H3=-242kJ•mol-1,
根据盖斯定律:②+③×2-①得:CH3OH(g)+$\frac{3}{2}$O2(g)=CO2(g)+2H2O(g)△H=-651kJ•mol-1,
故答案是:CH3OH(g)+$\frac{3}{2}$O2(g)=CO2(g)+2H2O(g)△H=-651kJ•mol-1;
(3)①根据该反应为放热反应,温度越高CO的转化率越小,所以曲线X为230℃,故答案为:X;
②由图可知,温度越高,CO的转化率越低,CO和 H2的起始组成比越小,CO的转化率越大,故答案为:温度越高,CO的转化率越低或n(H2):n(CO)越低,CO的转化率越大;
③由图象可知当270℃、CO的转化率为50%时,n(H2):n(CO)=1.5,则
CO(g)+2H2(g)?CH3OH (g)
起始(mol/L) 1 1.5
转化(mol/L) 0.5 1 0.5
平衡(mol/L) 0.5 0.5 0.5
K=$\frac{c(C{H}_{3}OH)}{c(CO)•{c}^{2}({H}_{2})}$=$\frac{0.5}{0.5×0.{5}^{2}}$=4.00,
故答案为:4.00.
点评 本题考查化学平衡问题,侧重于学生的分析和计算能力的考查,为高考常见题型和高频考点,注意把握图象曲线的变化趋势,把握平衡常数的计算方法,难度中等.

| A. | 升高温度 | B. | 加入生成物 | ||
| C. | 缩小容器体积 | D. | 增加反应物的物质的量 |
| A. | pH相同的 ①CH3COOK ②KHCO3 ③KClO三种溶液的c(K+):①>②>③ | |
| B. | 0.1mol/L NaHC2O4溶液与0.1mol/L NaOH溶液等体积混合,所得溶液中:C(Na+)>c(C2O42-)>c(HC2O4- )>c(OH-)>c(H+) | |
| C. | 常温下,0.1 mol/L Na2S溶液中存在:c(OH-)═c(H+)+c(HS-)+c(H2S) | |
| D. | 向0.2 mol•L-1的氨水中加入少量氯化铵固体,则溶液中$\frac{c(O{H}^{-})}{c(N{H}_{3}•{H}_{2}O)}$增大 |
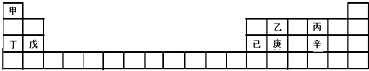
| A. | 甲、丁、戊的单质都是金属 | |
| B. | 乙、丙、辛都是非金属元素 | |
| C. | 乙、庚、辛都能形成氧化物 | |
| D. | 已的氧化物既可溶于KOH溶液又可溶于H2SO4溶液 |
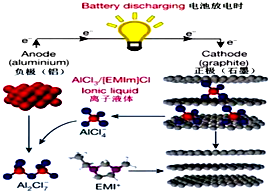 据2015年4月10日的报道,湖南大学 85后副教授鲁兵安参与斯坦福大学的团队刚刚发明出了一种“一分钟充满电”的新型铝离子电池.他们发现了一种新型石墨材料--泡沫石墨(graphite foam),泡沫石墨刚好可以充当电池的正极(负极用铝制成),而电解液则采用一种离子液体--即全由离子组成、室温下呈液态的离子化合物,具体成分为一种有机盐(化学表达式为[EMIm]Cl)与氯化铝的混合物.如图:关于该电池的说法不正确的是( )
据2015年4月10日的报道,湖南大学 85后副教授鲁兵安参与斯坦福大学的团队刚刚发明出了一种“一分钟充满电”的新型铝离子电池.他们发现了一种新型石墨材料--泡沫石墨(graphite foam),泡沫石墨刚好可以充当电池的正极(负极用铝制成),而电解液则采用一种离子液体--即全由离子组成、室温下呈液态的离子化合物,具体成分为一种有机盐(化学表达式为[EMIm]Cl)与氯化铝的混合物.如图:关于该电池的说法不正确的是( )| A. | 放电时,铝电极的电极反应式为:Al+7AlCl4--3e-═4Al2Cl7- | |
| B. | [EMIm]Cl中既含离子键,又含共价键 | |
| C. | 电子流向为:石墨通过离子液体流向铝 | |
| D. | 充电时石墨电极的电极反应式为:Cn[AlCl4]-e-═Cn+AlCl4- |
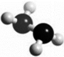 肼(N2H4)是火箭燃料,常温下为液体,其分子的球棍模型如图所示.肼能与双氧水发生反应:N2H4+2H2O2═N2+4H2O.下列说法正确的是( )
肼(N2H4)是火箭燃料,常温下为液体,其分子的球棍模型如图所示.肼能与双氧水发生反应:N2H4+2H2O2═N2+4H2O.下列说法正确的是( )| A. | 标准状况下,11.2L N2H4中含共用电子对数为2.5NA | |
| B. | 1mol N2H4和1mol H2O2含有的电子总数不相等 | |
| C. | 若生成3.6g H2O,则上述反应转移电子的数目为0.2 NA | |
| D. | N2H4和H2O2均只含有极性共价键 |
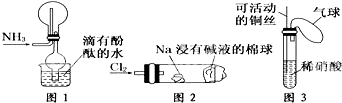
①实验室收集氨气采用图1所示装置
②实验室中做氯气与钠反应实验时采用图2所示装置
③实验室中采用图3所示装置进行铜与稀硝酸的反应
④实验室中用玻璃棒分别蘸取浓盐酸和浓氨水做氨气与酸生成铵盐的实验.
| A. | ②③④ | B. | ①②④ | C. | ①②③ | D. | ①③④ |
| 选项 | 叙述Ⅰ | 叙述Ⅱ |
| A | 1-己醇的沸点比己烷的沸点高89℃ | 1-己醇和己烷可通过蒸馏初步分离 |
| B | 原电池可将化学能转化为电能 | 原电池需外接电源才能工作 |
| C | H2SO4是离子化合物 | 硫酸溶液可导电 |
| D | 乙二酸可与KMnO4溶液发生反应 | 乙二酸具有酸性 |
| A. | A | B. | B | C. | C | D. | D |