题目内容
11.下列叙述I和II均正确并有因果关系的是( )| 选项 | 叙述Ⅰ | 叙述Ⅱ |
| A | 1-己醇的沸点比己烷的沸点高89℃ | 1-己醇和己烷可通过蒸馏初步分离 |
| B | 原电池可将化学能转化为电能 | 原电池需外接电源才能工作 |
| C | H2SO4是离子化合物 | 硫酸溶液可导电 |
| D | 乙二酸可与KMnO4溶液发生反应 | 乙二酸具有酸性 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.含有氢键的物质熔沸点较高;互溶且熔沸点不同液体可以采用蒸馏方法分离;
B.原电池为自发进行的氧化还原反应,不需要外接电源;
C.硫酸不是离子化合物,是共价化合物;
D.高锰酸钾具有强氧化性,二者发生了氧化还原反应.
解答 解:A.含有氢键的物质熔沸点较高,1-己醇中含有氢键、己烷中不含氢键,所以1-己醇熔沸点高于己烷;互溶且熔沸点不同液体可以采用蒸馏方法分离,二者互溶且熔沸点不同,所以可以采用蒸馏方法分离,故A正确;
B.原电池可将化学能转化为电能的装置,由于原电池中的反应为自发进行的氧化还原反应,则不需要外接电源,所以叙述Ⅱ驳不合理,故B错误;
C.叙述Ⅰ错误,硫酸为共价化合物,硫酸溶液导电原因是硫酸在溶液中电离出氢离子和硫酸根离子,故C错误;
D.高锰酸钾具有强氧化性,能氧化还原性物质,能氧化乙二酸,说明乙二酸没有还原性,不能说明乙二酸具有酸性,故D错误;
故选A.
点评 本题考查较综合,涉及原电池和电解池原理、离子化合物与导电的关系、熔沸点高低比较、羧酸的性质等知识点,为高频考点,明确化学原理、物质结构和性质是解本题关键,试题培养了学生的分析能力及化学实验能力.

练习册系列答案
相关题目
2.下列事实不能用元素周期律解释的是( )
| A. | 向Na2SO3溶液中加盐酸,有气泡产生 | |
| B. | 0.1 mol•L-1溶液的pH:NaOH>LiOH | |
| C. | Mg、Al与同浓度盐酸反应,Mg更剧烈 | |
| D. | 气态氢化物的稳定性:HBr>HI |
19.向含MgCl2、AlCl3均为nmol的混合液中逐滴加入NaOH溶液至过量,生成沉淀与加入NaOH的物质的量关系正确的是( )(有关离子沉淀或沉淀溶解与pH关系如表)
| 离子 | Mg2+ | Al3+ | 物质 | Al(OH)3 |
| 开始沉淀时的pH | 8.93 | 3.56 | 开始溶解时的pH | 8.04 |
| 完全沉淀时的pH | 10.92 | 4.89 | 完全溶解时的pH | 12.04 |
| A. |  | B. |  | C. |  | D. |  |
16.下列说法不正确的是( )
| A. | 天然气的主要成分是甲烷,它属于不可再生能源 | |
| B. | 煤是复杂的混合物,含有苯、甲苯、二甲苯等一系列重要的化工原料 | |
| C. | 石油分馏得到的汽油、煤油、柴油等都有混合物,没有固定的熔沸点 | |
| D. | 石油炼制的目的是为了获得轻质油和重要化工原料(乙烯、丙烯等) |
3.理论上下列反应不能设计成原电池反应的是( )
| A. | 2Fe3++Cu═2Fe2++Cu2+ | B. | Zn+2H+═Zn2++H2↑ | ||
| C. | 2H2+O2═2H2O | D. | H++OH-═H2O |
1. 用如图所示装置进行如下实验时,实验设计合理、现象描述正确的是( )
用如图所示装置进行如下实验时,实验设计合理、现象描述正确的是( )
 用如图所示装置进行如下实验时,实验设计合理、现象描述正确的是( )
用如图所示装置进行如下实验时,实验设计合理、现象描述正确的是( ) | X气体 | Y溶液 | Z溶液 | 试管中现象 | |
| A | Cl2 | 碘化亚铁和苯混合液 | H2O | 上层溶液显紫色,下层溶液显黄色 |
| B | CO2和NH3 | 氯化钡溶液 | H2SO4 | 白色沉淀 |
| C | SO2 | 紫色石蕊试液 | NaOH | 石蕊先变红后褪色 |
| D | HCHO | 新制氢氧化铜 | KMnO4 | 砖红色沉淀 |
| A. | A | B. | B | C. | C | D. | D |
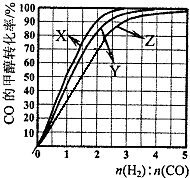 甲醇是新型的汽车动力燃料.工业上可通过CO和H2化合制备甲醇,该反应的热化学方程式为:CO (g)+2H2(g)?CH3OH (g)△H1=-116kJ•mol-1
甲醇是新型的汽车动力燃料.工业上可通过CO和H2化合制备甲醇,该反应的热化学方程式为:CO (g)+2H2(g)?CH3OH (g)△H1=-116kJ•mol-1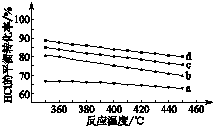 用Cl2生产含氯有机物时会产生HCl.利用反应4HCl(g)+O2(g)?2Cl2(g)+2H2O(g)可实现氯的循环利用.
用Cl2生产含氯有机物时会产生HCl.利用反应4HCl(g)+O2(g)?2Cl2(g)+2H2O(g)可实现氯的循环利用.
