题目内容
9.下列有关电解质溶液的说法正确的是( )| A. | pH相同的 ①CH3COOK ②KHCO3 ③KClO三种溶液的c(K+):①>②>③ | |
| B. | 0.1mol/L NaHC2O4溶液与0.1mol/L NaOH溶液等体积混合,所得溶液中:C(Na+)>c(C2O42-)>c(HC2O4- )>c(OH-)>c(H+) | |
| C. | 常温下,0.1 mol/L Na2S溶液中存在:c(OH-)═c(H+)+c(HS-)+c(H2S) | |
| D. | 向0.2 mol•L-1的氨水中加入少量氯化铵固体,则溶液中$\frac{c(O{H}^{-})}{c(N{H}_{3}•{H}_{2}O)}$增大 |
分析 A.酸性CH3COOH>H2CO3 >HClO,pH相同的 ①CH3COOK ②KHCO3 ③KClO三种溶液中氢离子浓度相同,盐对应酸的酸性越强,盐水解程度越弱;
B..将0.1mol/L的NaHC2O4溶液与0.1mol/L的NaOH溶液等体积混合后,二者恰好完全反应生成0.05mol/L的 Na2C2O4,溶液中存在电荷守恒和物料守恒,据此分析解答;
C.常温下,0.1 mol/L Na2S溶液中存在质子守恒,水电离出氢氧根离子和氢离子浓度总数相同;
D.向0.2 mol•L-1的氨水中加入少量氯化铵固体一水合氨电离平衡逆向进行;
解答 解:A.酸性CH3COOH>H2CO3 >HClO,pH相同的 ①CH3COOK ②KHCO3 ③KClO三种溶液中氢离子浓度相同,盐对应酸的酸性越强,盐水解程度越弱,c(K+):①>②>③,故A正确;
B.钠离子不水解、草酸根离子水解但水解程度较小,草酸根离子两步水解都生成氢氧根离子,所以溶液中离子浓度大小顺序是c (Na+)>c (C2O42-)>c (OH-)>c(HC2O4-)>c(H+),故B错误;
C.常温下,0.1 mol/L Na2S溶液中存在质子守恒,水电离出氢氧根离子和氢离子浓度总数相同,c(OH-)═c(H+)+c(HS-)+2c(H2S),故C错误;
D.0.2 mol•L-1的氨水中存在电离平衡NH3•H2O?NH4++OH-,加入少量氯化铵固体,平衡逆向进行氢氧根离子浓度减小,一水合氨浓度增大,比值$\frac{c(O{H}^{-})}{c(N{H}_{3}•{H}_{2}O)}$减小,故D错误;
故选A.
点评 本题考查了电解质溶液中离子浓度大小比较、电解质溶液中质子守恒、物料守恒等,注意弱电解质电离平衡的应用,掌握基础是解题关键,题目难度中等.

 精英口算卡系列答案
精英口算卡系列答案| A. | 铜 | B. | 硝酸钾溶液 | C. | 氢氧化钠 | D. | 蔗糖 |
| A. | 反应中CO2是还原产物 | |
| B. | 氧化剂与还原剂的物质的量之比为1:2 | |
| C. | 1mol H2C2O4参加反应转移4mol电子 | |
| D. | 当反应中有1mol电子转移时,有67.5g ClO2生成 |
| A. | V(Y)=0.02mol•L-1•min-1 | B. | V(Z)=0.10mol•L-1•min-1 | ||
| C. | V(X)=0.03mol•L-1•min-1 | D. | V(W)=0.02mol•L-1•s-1 |
| A. | PM2.5含有的铅、镉、铬、钒、砷等对人体有害的元素均是金属元素 | |
| B. | “雾霾天气”、“温室效应”、“光化学烟雾”的形成都与氮氧化物有关 | |
| C. | 塑化剂是一种化工塑料软化剂,可以大量添加到婴幼儿玩具中 | |
| D. | 酒精可使蛋白质变性,故能消毒杀菌 |
| 离子 | Mg2+ | Al3+ | 物质 | Al(OH)3 |
| 开始沉淀时的pH | 8.93 | 3.56 | 开始溶解时的pH | 8.04 |
| 完全沉淀时的pH | 10.92 | 4.89 | 完全溶解时的pH | 12.04 |
| A. | 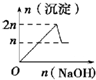 | B. |  | C. |  | D. | 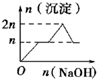 |

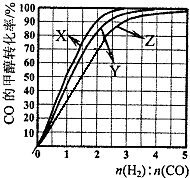 甲醇是新型的汽车动力燃料.工业上可通过CO和H2化合制备甲醇,该反应的热化学方程式为:CO (g)+2H2(g)?CH3OH (g)△H1=-116kJ•mol-1
甲醇是新型的汽车动力燃料.工业上可通过CO和H2化合制备甲醇,该反应的热化学方程式为:CO (g)+2H2(g)?CH3OH (g)△H1=-116kJ•mol-1