题目内容
1.FeCl3可用作印刷电路铜板腐蚀剂,为回收废腐蚀液中的铜,必须对废腐蚀液的组成进行分析.某同学去废腐蚀液200mL,分成甲、乙两等份.向甲溶液中滴加AgNO3溶液至不再有沉淀产生,得到沉淀129.15g;向乙溶液中加入10g足量铁粉,充分反应,剩余固体质量4.8g.计算中忽略溶液体积的变化.(1)废腐蚀液中含有Cl-的物质的量浓度是9mol/L.
(2)废腐蚀液中铜离子的物质的量浓度是0.5mol/L.
分析 (1)根据Ag++Cl-=AgCl↓结合氯化银质量进行计算;
(2)根据固体质量变化结合金属铁和铜离子之间的置换反应来计算即可.
解答 解:(1)Ag++Cl-=AgCl↓,生成氯化银沉淀129.15g,即0.9mol,所以氯离子的物质的量是0.9mol,浓度是$\frac{0.9mol}{0.1L}$=9mol/L,故答案为:9mol/L;
(2)在溶液中,根据固体质量的变化可以得出:n(Cu)×64g/mol+10g-$\frac{129.15g}{143.5g/mol}$×$\frac{1}{3}$×$\frac{1}{2}$×56g/mol=4.8g
n(Cu)=0.05mol,n(CuCl2)=n(Cu)=0.05mol
c(Cu2+)=$\frac{0.05mol}{0.1L}$=0.5mol/L,故答案为:0.5mol/L.
点评 本题考查金属铁、铜以及的化合物之间的转化知识,注意知识的联系和归纳,难度不大.

练习册系列答案
 小学生10分钟口算测试100分系列答案
小学生10分钟口算测试100分系列答案
相关题目
11.工业上硫酸中的一步重要反应是SO2在400~5000C下的催化氧化:2SO2+O2?2SO3,这是一个正反应放热的可逆反应.如果在密闭容器中通入2molSO2和足够多的氧气,按上述条件进行反应,下列有关说法中错误的是( )
| A. | 无论反应时间长短,最终生成的SO3一定少于2 mol | |
| B. | 使用催化剂的目的是加快反应速率,提高生产效率 | |
| C. | 达到平衡时,SO2和SO3的物质的量相等 | |
| D. | 该反应在较高温度下进行,有利于提高SO3的产率 |
16.在实验室模拟工业生产碳酸钠:一定温度下,往一定量饱和NaCl溶液中通入氨气达到饱和后,再不断通入CO2,一段时间后,出现沉淀,过滤得到NaHCO3晶体.
(1)该过程的化学方程式:NaCl+NH3+CO2+H2O=NaHCO3↓+NH4Cl.
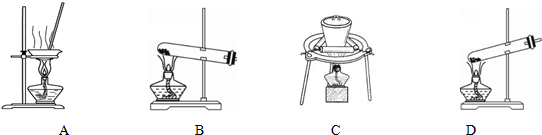
(2)加热NaHCO3得到纯碱制品,实验室可进行此操作的装置是BC.
(3)得到的纯碱制品含有少量NaHCO3和NaCl,设计实验验证样品中各种组分.
试剂和仪器限选用:试管、胶头滴管、过滤装置、Ba(NO3)2溶液、NaOH溶液、AgNO3溶液、澄清石灰水、稀硫酸、稀盐酸、稀硝酸.
(1)该过程的化学方程式:NaCl+NH3+CO2+H2O=NaHCO3↓+NH4Cl.
(2)加热NaHCO3得到纯碱制品,实验室可进行此操作的装置是BC.

(3)得到的纯碱制品含有少量NaHCO3和NaCl,设计实验验证样品中各种组分.
试剂和仪器限选用:试管、胶头滴管、过滤装置、Ba(NO3)2溶液、NaOH溶液、AgNO3溶液、澄清石灰水、稀硫酸、稀盐酸、稀硝酸.
| 步骤一:取少量制品于试管中,加少量蒸馏水,振荡,溶解.往试管中加入过量的Ba(NO3)2溶液 振荡,观察; | 现象:溶液中产生大量白色沉淀; 结论:试样中含有Na2CO3. |
| 步骤二:将步骤一的浊液过滤,取滤液于试管中B中,加入适量的NaOH溶液, 振荡,观察; | 现象:有少量白色沉淀生成; 结论:样品中含有NaHCO3. |
| 步骤三:将步骤二的浊液过滤,取滤液于试管C中,先加入足量的稀硝酸 再加入少许AgNO3溶液振荡,观察. | 现象:有少量白色沉淀生成; 结论:试样中含有NaCl. |
6.某离子反应中共有H20、H2C2O4、ClO3-、H+、CO2、ClO2六种微粒参与,已知在反应过程中溶液的pH逐渐增大.下列判断正确的是( )
| A. | 反应中CO2是还原产物 | |
| B. | 氧化剂与还原剂的物质的量之比为1:2 | |
| C. | 1mol H2C2O4参加反应转移4mol电子 | |
| D. | 当反应中有1mol电子转移时,有67.5g ClO2生成 |
2.下列事实不能用元素周期律解释的是( )
| A. | 向Na2SO3溶液中加盐酸,有气泡产生 | |
| B. | 0.1 mol•L-1溶液的pH:NaOH>LiOH | |
| C. | Mg、Al与同浓度盐酸反应,Mg更剧烈 | |
| D. | 气态氢化物的稳定性:HBr>HI |
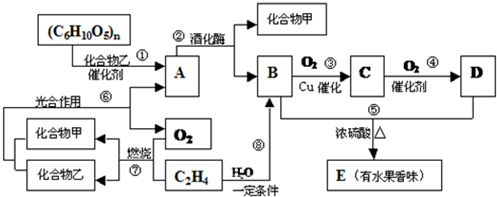
 .
.
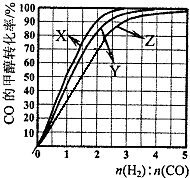 甲醇是新型的汽车动力燃料.工业上可通过CO和H2化合制备甲醇,该反应的热化学方程式为:CO (g)+2H2(g)?CH3OH (g)△H1=-116kJ•mol-1
甲醇是新型的汽车动力燃料.工业上可通过CO和H2化合制备甲醇,该反应的热化学方程式为:CO (g)+2H2(g)?CH3OH (g)△H1=-116kJ•mol-1