题目内容
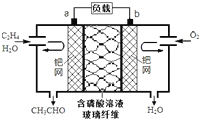 乙烯催化氧化成乙醛可设计成如图所示的燃料电池,能在制备乙醛的同时获得电能,其总反应为:2CH2=CH2+O2→2CH3CHO.下列有关说法正确的是( )
乙烯催化氧化成乙醛可设计成如图所示的燃料电池,能在制备乙醛的同时获得电能,其总反应为:2CH2=CH2+O2→2CH3CHO.下列有关说法正确的是( )| A、该电池为可充电电池 |
| B、电子移动方向:电极a→磷酸溶液→电极b |
| C、正极反应式为:CH2=CH2-2e-+2OH-→CH3CHO+H2O |
| D、每有0.1mol O2反应,则迁移H+0.4mol |
考点:原电池和电解池的工作原理
专题:电化学专题
分析:由总反应式可知CH2=CH2被氧化,应为原电池的负极反应,因电解质溶液呈酸性,则负极电极方程式为CH2=CH2-2e-+H2O=CH3CHO+2H+,正极通入氧气,发生还原反应,电极方程式为O2+4H++4e-═2H2O,以此解答该题.
解答:
解:A.充电时,不能生成乙烯和氧气,不是充电电池,故A错误;
B.电子只能经过导线,不能经过溶液,故B错误;
C.正极发生还原反应,电极方程式为O2+4H++4e-═2H2O,负极为CH2=CH2-2e-+H2O=CH3CHO+2H+,故C错误;
D.由电极方程式O2+4H++4e-═2H2O可知,每有0.1mol O2反应,则迁移H+0.4mol,故D正确.
故选D.
B.电子只能经过导线,不能经过溶液,故B错误;
C.正极发生还原反应,电极方程式为O2+4H++4e-═2H2O,负极为CH2=CH2-2e-+H2O=CH3CHO+2H+,故C错误;
D.由电极方程式O2+4H++4e-═2H2O可知,每有0.1mol O2反应,则迁移H+0.4mol,故D正确.
故选D.
点评:本题考查了原电池原理的应用,为高频考点,注意掌握电极方程式的书写是解决本题的关键,易错点为B,注意电子不能流经溶液,题目难度中等.

练习册系列答案
相关题目
X、Y、Z、W是原子序数依次增大的四种短周期元素,甲、乙、丙、丁、戊是由其中的两种或三种元素组成的化合物,己是由Z元素形成的单质.已知:甲+乙=丁+己,甲+丙=戊+己;0.1mol?L-1丁溶液的pH为13(25℃).下列说法正确的是( )
| A、1 mol甲与足量的乙完全反应共转移了1 mol电子 |
| B、Y元素在周期表中的位置为第三周期第ⅣA族 |
| C、原子半径:W>Z>Y>X |
| D、1.0 L 0.1 mol?L-1戊溶液中阴离子总的物质的量小于0.1 mol |
下列叙述不正确的是( )
| A、通过1H核磁共振谱图可以区分乙醇和乙酸乙酯 |
| B、常温常压下,5.6g乙烯与丁烯的混合物中含有共用电子对数目为1.2NA(设NA为阿伏加德罗常数的值.) |
| C、在50g质量分数为56%的乙醇水溶液中,含有氢原子总数为3NA(设NA为阿伏加德罗常数的值.) |
| D、煤干馏主要得到焦炭、煤焦油、粗氨水和焦炉气 |
用下列实验装置进行相应实验,设计正确且能达到实验目的是( )
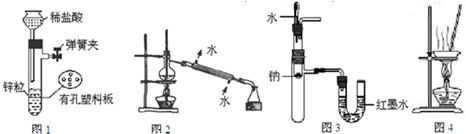

| A、用图1所示装置制取少量H2 |
| B、用图2所示装置分离Na2CO3溶液和CH3COOC2H5的混合物 |
| C、用图3所示装置验证Na和水反应的热效应 |
| D、用图4所示装置蒸干NH4Cl饱和溶液制备NH4Cl晶体 |
设NA为阿伏加德罗常数的值,下列说法中正确的是( )
| A、在1L 0.1mol/L的醋酸溶液中所含分子数目小于0.1NA |
| B、质量相同的N2和CO中,含有的电子数均为14NA |
| C、标准状况下,11.2L氮气和22.4L氢气在一定条件下充分反应,原子数目小于3NA |
| D、在V L 0.1mol/L的氯化铁溶液中,若Fe3+的数目为NA,Cl-的数目大于3NA |
化学与生产和生活密切相关,下列说法正确的是( )
| A、误食重金属盐引起人体中毒,可喝大量的食盐水解毒 |
| B、变质的油脂有难闻的特殊气味,是由于油脂发生了水解反应 |
| C、浸泡过高锰酸钾溶液的硅藻土放于水果箱内是为了延长水果保鲜期 |
| D、安装煤炭燃烧过程的“固硫”装置,主要是为了提高煤的利用率 |
设NA为阿伏加德罗常数的值.下列叙述正确的是( )
| A、0.1mol乙烯和乙醇的混合物完全燃烧所消耗的O2一定为0.3NA |
| B、常温常压下,46g NO2与N2O4的混合气体中含有的分子总数为NA |
| C、25℃时,pH=13的Ba(OH)2溶液中含有OH-的数目为0.1NA |
| D、一定量的钠与8g氧气作用,若两者均无剩余,转移NA个电子 |
 某化学研究小组探究溴化亚铁水溶液与氯气反应.
某化学研究小组探究溴化亚铁水溶液与氯气反应.