题目内容
设NA为阿伏加德罗常数的值.下列叙述正确的是( )
| A、0.1mol乙烯和乙醇的混合物完全燃烧所消耗的O2一定为0.3NA |
| B、常温常压下,46g NO2与N2O4的混合气体中含有的分子总数为NA |
| C、25℃时,pH=13的Ba(OH)2溶液中含有OH-的数目为0.1NA |
| D、一定量的钠与8g氧气作用,若两者均无剩余,转移NA个电子 |
考点:阿伏加德罗常数
专题:阿伏加德罗常数和阿伏加德罗定律
分析:A.乙醇的分子式为C2H6O,可以表示为C2H4H2O,消耗氧气的部分为C2H4;
B.NO2与N2O4的摩尔质量不同,无法计算混合气体的物质的量;
C.没有告诉氢氧化钡溶液的体积,无法计算溶液中氢氧根离子的数目;
D.钠与氧气反应才氧化钠和过氧化钠,氧元素的化合价不同,无法计算转移的电子数.
B.NO2与N2O4的摩尔质量不同,无法计算混合气体的物质的量;
C.没有告诉氢氧化钡溶液的体积,无法计算溶液中氢氧根离子的数目;
D.钠与氧气反应才氧化钠和过氧化钠,氧元素的化合价不同,无法计算转移的电子数.
解答:
解:A.0.1mol乙烯完全燃烧消耗0.3mol氧气,0.1mol乙醇完全燃烧消耗0.3mol氧气,所以0.1mol乙烯和乙醇的混合物完全燃烧所消耗的氧气的物质的量为0.3mol,所消耗的O2一定为0.3NA,故A正确;
B.二氧化氮与四氧化二氮的摩尔质量不同,无法计算46g混合物的物质的量及分子数,故B错误;
C.缺少氢氧化钡溶液的体积,我放暑假溶液中氢氧根离子的物质的量及数目,故C错误;
D.8g氧气中含有8g氧原子,含有0.5mol氧原子,由于反应产物中,氧化钠、过氧化钠中氧元素化合价不同,无法计算转移的电子数,故D错误;
故选A.
B.二氧化氮与四氧化二氮的摩尔质量不同,无法计算46g混合物的物质的量及分子数,故B错误;
C.缺少氢氧化钡溶液的体积,我放暑假溶液中氢氧根离子的物质的量及数目,故C错误;
D.8g氧气中含有8g氧原子,含有0.5mol氧原子,由于反应产物中,氧化钠、过氧化钠中氧元素化合价不同,无法计算转移的电子数,故D错误;
故选A.
点评:本题考查阿伏加德罗常数的有关计算和判断,题目难度中等,注意掌握好以物质的量为中心的各化学量与阿伏加德罗常数的关系,选项C、D为易错点,注意C中缺少溶液体积、D中反应产物中氧元素化合价情况.

练习册系列答案
 习题精选系列答案
习题精选系列答案
相关题目
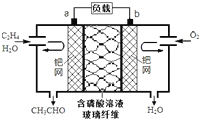 乙烯催化氧化成乙醛可设计成如图所示的燃料电池,能在制备乙醛的同时获得电能,其总反应为:2CH2=CH2+O2→2CH3CHO.下列有关说法正确的是( )
乙烯催化氧化成乙醛可设计成如图所示的燃料电池,能在制备乙醛的同时获得电能,其总反应为:2CH2=CH2+O2→2CH3CHO.下列有关说法正确的是( )| A、该电池为可充电电池 |
| B、电子移动方向:电极a→磷酸溶液→电极b |
| C、正极反应式为:CH2=CH2-2e-+2OH-→CH3CHO+H2O |
| D、每有0.1mol O2反应,则迁移H+0.4mol |
下列各组离子在水溶液中能大量共存的是( )
| A、Na+、Fe3+、I-、CO32- |
| B、K+、Fe2+、Cl-、NO3- |
| C、H+、Na+、SiO32-、CH3COO- |
| D、Ag+、K+、Br-、NO3- |
下列装置的设计能达到实验目的是( )
A、 除去乙醇中的乙酸 |
B、 形成原电池 |
C、 分离水和四氯化碳 |
D、 干燥HI |
下列叙述不正确的是( )
| A、常温下,SO2、NO2、Cl2均为有刺激性气味、有毒的气体 |
| B、Na2CO3粉末遇水生成含有结晶水的碳酸钠晶体,该晶体一定是Na2CO3?10H2O |
| C、人工合成的硅橡胶是目前最好的、既耐高温又耐低温的橡胶 |
| D、合金的硬度可以大于它的纯金属成分,合金的熔点也可以低于它的成分金属 |
下列图示与对应叙述相符合的是( )
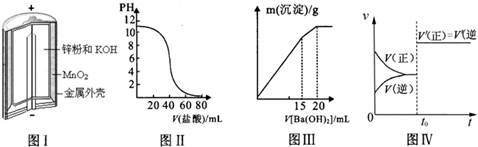

| A、图Ⅰ所示锌锰碱性电池正极的电极反应式为:MnO2+H2O+2e-═MnOOH+OH- |
| B、图Ⅱ表示盐酸滴加到0.1mol?L-1某碱溶液中得到的滴定曲线,由图Ⅱ可知二者恰 好中和时,所得溶液的pH>7 |
| C、图Ⅲ表示某明矾溶液中加入Ba(OH)2溶液时,沉淀的质量与加入Ba(OH)2溶液体积的关系,在加入20mL Ba(OH)2溶液时,沉淀全部是BaSO4 |
| D、图Ⅳ表示已达平衡的某反应,在t0时改变某一条件后反应速率随时间变化,则改变的条件一定是加入催化剂 |
下列说法正确的是( )
| A、向1 mo1?L-l CH3COOH溶液中加入少量CH3COONa固体,由于CH3COONa水解显碱性,所以溶液的pH升高 | ||||||||||
B、25℃时,将a mol?L-l氨水与0.01mol?L-1盐酸等体积混合,反应完全时溶液中c(NH4+)=c(Cl-),用含a的代数式表示反应完全时NH3?H2O的电离常数Kb=
| ||||||||||
C、根据表中数据可以计算出 (g)+3H2(g)→ (g)+3H2(g)→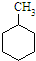 (g)的焓变 (g)的焓变
| ||||||||||
| D、已知298K时,MgCO3的Ksp=6.82×10-6,溶液中c(Mg2+)=0.0001mol?L-1,c(CO32-)=0.0001mol?L-1,此时Mg2+和CO32-不能共存 |
描述或解释下列现象的离子方程式,正确的是( )
| A、Fe(OH)3溶于氢碘酸中:Fe(OH)3+3H+═Fe3++3H2O |
| B、腐蚀法制作印刷线路板2Fe3++Cu═2Fe2++Cu2+ |
| C、碳酸氢铵溶液中加足量石灰水:HCO3-+Ca2++OH-═CaCO3↓+H2O |
| D、用惰性电极电解熔融氯化钠:2Cl-+2H2O═Cl2↑+H2↑+2OH- |
在生活、生产中为增大反应速率而采取的措施合理的是( )
| A、食物放在冰箱中 |
| B、塑料制品中添加抑制剂 |
| C、在糕点包装内放置小包除氧剂 |
| D、燃煤发电时用煤粉代替煤块 |